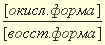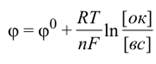Зависимость электродного потенциала от концентрации уравнение нернста
Глава 5. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
5.1. Теоретическая часть
Электрохимические процессы, как и окислительно-восстановительные реакции (ОВР), связаны с изменением степени окисления веществ, участвующих в реакции. Основное отличие ОВР от электрохимических процессов заключается в том, что процессы восстановления и окисления пространственно разделены и перенос электронов может быть зафиксирован как некоторый ток (в гальваническом элементе, при коррозии) или, наоборот, электрохимический процесс может происходить за счет внешнего источника тока (электролиз).
В любом случае для протекания электрохимической реакции необходима электрохимическая цепь, существенными компонентами которой являются электроды и электролит (водный или неводный).
Под электродами обычно понимают или собственно некий проводник или систему, состоящую из проводника, погруженного в раствор электролита. При контакте металлического проводника с раствором электролита на его поверхности возникает некий заряд, за счет переноса электронов, что приводит к возникновению разности электростатических потенциалов между электродом и находящимся с ним в контакте электролитом. Эта разность называется электродным потенциалом.
Абсолютную величину электродного потенциала отдельного электрода измерить невозможно, поэтому измеряют всегда разность потенциалов исследуемого электрода и некоторого стандартного электрода сравнения, т.е. составляют электрохимическую цепь. В качестве электродов сравнения для водных сред используют хлорсеребряный или обратимый водородный электрод сравнения. Последний представляет собой платинированную (электрохимическим способом осажденную на платиновую пластину) платину, погруженную в раствор кислоты (серной, соляной) с активностью ионов водорода равной 1, через который продувают водород при давлении 101кПа. В системе устанавливается равновесие
H2(г) 


Потенциал этого равновесия в указанных условиях принят равным нулю при любых температурах.
Табличные значения стандартных электродных потенциалов (E o ) приведены относительно обратимого водородного электрода. Эти значения нормированы на один электрон и их относят к процессу восстановления:
В практических работах в качестве электрода сравнения чаще, чем водородный, используют хлорсеребряный электрод. Хлорсеребряный электрод представляет собой серебряную проволоку, электролитически покрытую AgCl, помещенную в насыщенный раствор KCl.
Стандартные электродные потенциалы металлов и водорода, расположенные в порядке их возрастания, составляют ряд стандартных электродных потенциалов металлов, или электрохимический ряд напряжений металлов. Ряд электродных потенциалов дает полезные знания:
1.Металлы, имеющие значения электродного потенциала меньше, чем у водорода, могут растворяться с выделением водорода в кислотах, анионы которых не являются окислителями.
2.Металлы, имеющие большее, чем у водорода, значение стандартного электродного потенциала могут встречаться в природе в самородном виде.
3.Металлы, имеющие меньшее значение электродного потенциала могут вытеснять металлы с большим значением электродного потенциала из растворов их солей.
4.Металлы, имеющие электродный потенциал меньше, чем потенциал реакции
в стандартных условиях могут растворяться в воде с выделением водорода.
Под гальваническим элементом понимают единичные ячейки химических источников тока, предназначенных для однократного электрического разряда. Гальванический элемент представляет собой два электрода различной природы и электролит. Максимальная разность потенциалов этих электродов в отсутствие электрического тока называется электродвижущей силой (э.д.с.) гальванического элемента. Э.д.с. может быть рассчитана как разность равновесных потенциалов этих электродов.
Для гальванического элемента, составленного из железного и медного электродов э.д.с. будет равна:
Fe 2+ + 2e =Fe E o = –0,44
Cu 2+ +2e=Cu E o =+0,34
э.д.с. =+ 0,34 – ( –0,44) =0,77В,
Зависимость электродного потенциала от концентраций дает уравнение Нернста.
E= E o +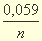
Электролиз – совокупность электрохимических окислительно-восстановительных реакций, проходящих при прохождении электрического тока через электролит, с погруженными в него электродами.
При электролизе растворов нужно учитывать возможность разряда на электродах нейтральных молекул растворителя – воды:
Возможность протекания электродной реакции разряда ионов металла или молекул воды определяется значением электродного потенциала. Если стандартный электродный потенциал реакции разряда металла
Ме n+ + ne = Me (5.1)
имеет положительное значение, то в стандартных условиях на катоде будет выделяться металл. Если Е о реакции (5.1) меньше, чем потенциал реакции разряда воды (–0,83В), то на катоде выделяется только водород. В остальных случаях параллельно протекают оба процесса.
Например, при электролизе раствора CuSO4
на катоде выделяется медь. На аноде выделяется кислород, а в растворе накапливается кислота.
Коррозией называется процесс самопроизвольного разрушения металлов под влиянием внешней среды. Коррозия – окислительно-восстановительная реакция, сопровождающаяся переходом металла в ионное состояние.
Разрушение металла при соприкосновении с электролитом с возникновением в системе электрического тока называется электрохимической коррозией.
В атмосферных условиях роль электролита играет водяная пленка на металлической поверхности, в которой растворены электропроводящие примеси. Электродами являются сам металл и содержащиеся в нем примеси. В таком гальваническом элементе примеси, имеющие большее значение электродного потенциала играют роль катода, а сам металл является анодом. На катоде обычно выделяется водород из молекул или ионов среды, а анод растворяется, т.е. подвергается коррозии. Например, при контакте железа с медью в растворе соляной кислоты образуется гальванический элемент:
Fe|Fe 2+ , HCl, Cu 2+ |Cu+
На аноде Fe –2e = Fe 2+ ,
На катоде (Cu) 2H + + 2e = H2
Суммарная реакция Fe + 2H + = H2 + Fe 2+ ,
Если реакция проходит в атмосферных условиях в воде, процесс усложняется другим процессом, связанным с растворенным в электролите кислородом, который на катоде может участвовать в реакции, именуемой кислородной деполяризацией катода
В этом случае ионы железа соединяются с перешедшими в раствор ионами OH — и окисляются кислородом воздуха,
Fe 2+ + 2OH – = Fe(OH)2
Последний частично отщепляет воду
Полученное вещество примерно отвечает составу бурой ржавчины.
По характеру защитного действия против электрохимической коррозии различают анодные и катодные покрытия. К анодным относят такие покрытия, в которых покрывающий металл обладает более отрицательным потенциалом, чем защищаемый (оцинкованное железо). К катодным относятся покрытия металлом с большим значением электродного потенциала (луженое, т.е. покрытое оловом железо). Пока слой, покрывающий основной металл, полностью изолирует его от воздействия окружающей среды, принципиального различия между этими видами покрытый нет. При нарушении целостности покрытия создаются совершенно различные условия. Катодное покрытие престает защищать и усиливает своим присутствием коррозию. Анодное покрытие будет само подвергаться разрушению, продолжая защищать основной металл.
Для защиты металлов от коррозии часто химическим или электрохимическим путем формируют на его поверхности защитную оксидную пленку. Для алюминия используют электрохимический способ: анодирование. Для железа, применяют, например, кипячение в растворе солей фосфорной кислоты или в азотной кислоте.
5.1.1 Вопросы по теме
5.2.1. Цель работы
Изучение и сопоставление восстановительных свойств металлов
1 М HCl, 1M KOH (NaOH), 1 М растворы сульфатов (нитратов) алюминия, цинка, железа(II), олова (II), свинца (II), меди (II), серебра, пластинки цинка, алюминия, железа, свинца, меди, олова, магния, железная проволока
5.2.4.Порядок выполнения эксперимента
Опыт 1. Взаимодействие металлов с водой и кислотой
1) Налейте в 5 пробирок по 2 –3 мл 1 М HCl и поместите в них пластинки цинка, алюминия, железа, свинца, меди, предварительно очищенные наждачной бумагой. Отметьте наблюдаемое сразу после внесения металлов в пробирки и через некоторое время. Результаты занесите в табл.5.1.
2) Налейте в другие 5 пробирок по 2 –3 мл дистиллированной воды и поместите в них пластинки цинка, алюминия, железа, свинца, меди, предварительно очищенные наждачной бумагой. Отметьте наблюдаемое сразу после внесения металлов в пробирки и через некоторое время. Результаты занесите в табл.5.1.
3)Налейте в 5 пробирок по 1 мл дистиллированной воды и 1мл 1М КОН и поместите в них пластинки цинка, алюминия, железа, свинца, меди, предварительно очищенные наждачной бумагой. Отметьте наблюдаемое сразу после внесения металлов в пробирки и через некоторое время. Результаты занесите в табл.5.1.
Таблица 5.1.
Cu
Вопросы и задания:
- Опишите наблюдаемое
- Объясните результаты наблюдений с помощью ряда электродных потенциалов.
- Напишите уравнения реакций
Опыт 2. Сопоставление восстановительных свойств металлов в реакциях с растворами солей
1) Налейте в отдельные пробирки по 2 –3 мл растворов 1 М сульфатов (нитратов) алюминия, цинка, железа(II), олова (II), свинца (II), меди (II), серебра и поместите в каждую из них предварительно зачищенные наждачной бумагой пластинки алюминия.
2) В другую серию пробирок с 2 –3 мл растворов 1 М сульфатов (нитратов) алюминия, цинка, железа(II), олова (II), свинца (II), меди (II), серебра поместите предварительно зачищенные наждачной бумагой пластинки железа.
(Примечание:о чистить пластинку металла от оксидной пленки можно поместив ее на несколько минут в 1М HCl и затем быстро тщательно промыв дистиллированной водой поместить в испытуемый раствор.)
3) Аналогичную серию повторите с цинком и медью. Результаты наблюдений в опытах занесите в таблицу 5.1. Отметьте минусами те колонки, где не наблюдается реакция.
Вопросы и задания
- Напишите уравнения реакций.
- Расположите металлы в последовательности уменьшения восстановительной способности. В полученном ряду металлов над каждым из них напишите табличные значения стандартных электродных потенциалов. Отметьте характер изменения значений потенциалов в вашем ряду. Обоснуйте сделанные вами наблюдения с помощью величин стандартных электродных потенциалов.
5.2.5. Что должен предоставить студент преподавателю для сдачи работы
5.3.1. Цель работы
Определение зависимости электродного потенциала от рН и концентрации; определение эдс гальванического элемента
5.3.3. Приборы, оборудование.
Стакан на 100 мл, цилиндры на 10 и 25 мл, анализатор ЭКСПЕРТ 001 , платиновый электрод, хлорсеребряный электрод, рН-метр
5.3.4.Порядок выполнения работы
Опыт 3. Определение зависимости электродного (окислительно-восстановительного) потенциала пероксида водорода от рН.
Внимание! Избегайте попадания концентрированного пероксида водорода на кожу!
а) Отмерьте цилиндром 5мл 5% H2O2, добавьте 20 мл дистиллированной воды и перенесите в стакан на 50–100мл.
С помощью рН-метра измерьте рН и внесите результат в таблицу 5.2
В стакан поместите платиновый и хлорсеребряный электроды, подсоединенные к анализатору ЭКСПЕРТ 001-1. Электроды должны быть погружены в раствор.
Измерьте значение э.д.с. (показание прибора) и внесите результат в таблицу 5.2
Платина является катализатором разложения пероксида водорода, поэтому идет реакция H2O2 — 2e = O2 + 2H + E o = +0,68 В
После измерения э.д.с. тщательно ополосните электроды в стакане с дистиллированной водой, не вынимая их из штатива, и затем промокните фильтровальной бумагой. Эту процедуру следует повторять после каждого измерения э.д.с..
б) Отмерьте цилиндром 5 мл 5% H2O2, прилейте 5 мл 1 М серной кислоты добавьте дистиллированной воды до общего объема 25 мл и перенесите в другой стакан. Измерьте рН. Измерьте значение э.д.с. и внесите результаты в таблицу 5.2
в) То же самое, но вместо 5 мл возьмите 20 мл H2SO4.
г).д.) то же, что в б) и в), но вместо кислоты возьмите KOH
Таблица 5.2
Vэлект., мл
Показание прибора (э.д.с.), мВ
Еэксп, мВ
5 (H2SO4)
20 (H2SO4)
5 (KOH)
20 (KOH)
Вопросы и задания
- Из экспериментальных значений э.д.с. (показаний прибора)рассчитайте окислительно-восстановительный потенциал пероксида водорода (Еэксп), учитывая, что потенциал хлорсеребряного электродаЕ о = +0,22 В. Результаты внесите в таблицу.
- По полученным данным построите график зависимости Е от рН.
- Определите по графику стандартный электродный потенциал пероксида водорода, сравните с табличными данными.
Опыт 4. Изучение зависимости электродного потенциала пары Fe 2+/ Fe 3+ от концентрации
Приготовьте в 5 стаканах смеси растворов солей железа (II) и железа (III) в соотношениях, данных в таблице 5.3.
Измерьте э.д.с. с помощью прибора Эксперт-1. Электродами служат платиновый и хлорсеребряный.
Результаты внесите в таблицу 5.3.
Таблица 5.3.
Раствор соли Fe(II)
Раствор соли Fe(III)
Соотношение конц.Fe(II): Fe(III)
E 0 теор
э.д.с.теор
э.д.с.эксп (показание прибора)
10мл 1 М
10мл 1 М
10мл 1 М
10мл 0,1 М
10мл 0,1 М
10мл 1 М
10 мл 0,1 М
10 мл 0,1 М
K4[Fe(CN)6]
K3[Fe(CN)6]
Вопросы и задания
- Рассчитайте по уравнению Нернста (5.I0) теоретическое значение электродного потенциала пары Fe(II) | Fe(III) для каждого случая
- Рассчитайте теоретическое э.д.с. гальванического элемента, составленного из: Fe(II) | Fe(III) (Pt) и хлорсеребряного электрода. Потенциал хлорсеребряного электрода Е=+0,22В.
- Сравнитеизмеренное э.д.с. электрохимической цепи Fe(II) | Fe(III) (Pt)|| Ag|AgCl с теоретическим. Подчиняется полученная вами зависимость уравнению Нернста?
Опыт 5. Определение влияния состава электролита и концентрации ионов цинка на э.д.с.. гальванического элемента
Приготовьте 3 стакана по 50 –100 мл. В первый налейте 2 мл 1 М раствора сульфата цинка и 18 мл воды. Во второй налейте 10 мл 0,1 М ZnSO4 и 10 мл 1M KOH. В третий налейте 20 мл 1M щелочи и при перемешивании столько 0,1 М ZnSO4 из цилиндра, чтобы осадок полностью растворялся. Если вы обнаружили помутнение раствора, добавьте несколько капель 1 М щелочи. Отметьте объем прибавленного сульфата цинка.
Измерьте рН в каждом стакане и внесите значения в таблицу 5.4.
Поместите в первый стакан платиновый и хлорсеребряный электроды, соединенные с анализатором «Эксперт-001». По окончании измерений выньте электроды из раствора, тщательно промойте последовательно в стакане с 0,1 М серной кислотой а затем в стакане с дистиллированной водой и высушите фильтровальной бумагой. После этого внесите электроды во второй стакан с осадком гидроксида цинка и измерьте значение э.д.с.. Аналогично проводят измерения в третьем стакане с цинкатом калия.
Измерьте значение э.д.с. Результаты внесите в таблицу 5.4
Таблица 5.4
Раствор
E расч
э.д.с. расч, мВ
Показания прибора, (э.д.с.)мВ
ZnSO4
Zn(OH)2
K2[Zn(OH)4]
Вопросы и задания:
- Рассчитайте теоретические значения E и э.д.с. по уравнению Нернста (5.8) исходя из Пр(Zn(OH)2) =10 –17
Потенциал хлорсеребряного электрода Eхс= +0,22В.
5.3.5.Что должен предоставить студент преподавателю для сдачи работы
5.4.1. Цель работы
Получить медь и иод электролитическим способом, исследовать процессы коррозии, пассивации, ингибирования.
1M CuSO4, KClнас, 1 М KI, крахмал, 1 М Na2S2O3 , 1 М CuCl2, 65% HNO3 ,1% уротропин, фенолфталеин, цинк, олово, алюминий, магний, медь, свинец, хром, никель, железная проволока, 1M K3[Fe(CN)6], 1M H2SO4
Электролизер, прибор для определения атомной массы, электроды графитовые, провода, пробирки,
5.4.4. Порядок проведения работы
Опыт 6. Электролиз сульфата меди
Налейте в электролизер (рис) 1 М раствор сульфата меди. Опустите в раствор графитовые электроды и пропускайте постоянный ток (от 24 В) в течение 15 минут.
Вопрсы и задания:
- Напишите уравнения реакций, протекающих на катоде и аноде.
- Какой газ выделяется на аноде, какие изменения происходят с катодом.?
Поменяйте местами электроды в электролизере и снова пропускайте электрический ток в течение 15 минут.
Вопросы и задания
- Что происходит с медью на аноде?
- Напишите уравнение электролиза сульфата меди с медным анодом.
Опыт 7. Электролиз раствора иодида калия
В электролизер с раствором 1M KI опустите графитовые электроды, подсоединенные к источнику постоянного тока ( напряжение 24В). Добавьте в прикатодное пространство фенолфталеин, а в прианодное –несколько капель крахмала. Проводите электролиз в течение 15 минут.
По окончании опыта анод промойте раствором тиосульфата натрия, а затем дистиллированной водой.
Вопросы и задания
- Что наблюдается в прикатодном пространстве и почему?
- Как изменяется окраска раствора в прианодном пространстве и почему?
- Напишите уравнение электролиза водного раствора иодида калия.
Опыт 8. Коррозия железа и электрохимическая защита железа от коррозии
Приготовьте кусочки ( пластинки, фольги, проволоки) цинка, олова, алюминия, магния, меди, свинца, хрома, никеля ( по выбору преподавателя) Обмотайте имеющиеся кусочки металлов железными проволочками, тщательно очищенными наждачной бумагой. В несколько пробирок( по числу выбранных металлов) налейте по 5 мл дистиллированной воды, 1мл раствора 1 М серной кислоты и 0,5 мл 1 М K3[Fe(CN)6], последнее вещество является реактивом на ионы железа (II), в присутствии которых раствор окрашивается в синий цвет за счет образования «турнбулевой сини».
В одну из пробирок, так называемую контрольную, поместите отдельно железную проволоку ( без другого металла).
Отметьте, что происходит в контрольной пробирке. В остальные пробирки поместите приготовленные пары металл–железо.
Отметьте те пробирки и те металлы, в контакте с которыми железо не растворяется в серной кислоте, т.е. не наблюдается синее окрашивание раствора.
Результаты внесите в таблицу 5.5
Таблица 5.5
K3[Fe(CN)6]
Вопросы и задания
- Напишите уравнения реакций.
- Какие металлы защищают железо от коррозии?
- В чем состоит принципиальная разница в использовании оцинкованного и луженого железа?
- Напишите уравнения реакций коррозии оцинкованного и луженого железа при местном разрушении защитного слоя.
- Составьте схемы (в виде рисунков) реакций коррозии оцинкованного и луженого железа при местном разрушении защитного слоя. Укажите направление перехода электронов с одного металла на другой и перехода ионов в раствор.
- Можно ли использовать для защиты железа от коррозии свинец, медь, алюминий, никель, хром? Почему не все эти металлы применяются в качестве покрытий? Среди исследованных в опыте металлов отметьте те, которые могут быть использованы как катодное и как анодное покрытие.
Опыт 9. Активирующее влияние хлорид-ионов на разрушение защитной оксидной пленки
Возьмите 2 алюминиевые пластинки( на поверхности алюминия всегда имеется защитная пленка оксида алюминия, поэтому можно пользоваться алюминиевой посудой) размером 31 см 2 и опустите одну из них в 1 М раствор CuCl2, а другую в 1 М CuSO4.
Вопросы и задания
- Отметьте, что происходит в пробирках через 10–15 минут.
- Напишите уравнения реакций.
- Разрушает ли защитную пленку алюминиевой пластинки сульфат-ион?
- Можно ли долго кипятить подсоленную еду в алюминиевой посуде? Предложите обоснованные объяснения ускоряющего действия хлорид-ионов на коррозию алюминия в водных растворах.
Опыт 10. Химическое формирование защитной оксидной пленки на железе
Железную проволочку опустите на 1–2 минуты в 65% азотную кислоту. Обратите внимание, взаимодействует ли железо с концентрированной азотной кислотой. Затем извлеките проволоку из кислоты и промойте дистиллированной водой и внесите в раствор 1 М серной кислоты.
Достаньте проволоку из раствора, промойте дистиллированной водой, протрите наждачной бумагой (для чего?) и снова погрузите в раствор 1 М серной кислоты.
Вопросы и задания
- Опишите свои наблюдения
- Напишите уравнения реакций.
Опыт 11. Ингибирование
а) Соберите прибор для измерения объема газа. В одно колено пробирки Оствальда поместите кусочек цинка, предварительно протравленный соляной кислотой для удаления оксидной пленки. В другое колено налейте 4–5 мл 1 М серной кислоты. Пробирку и бюретку плотно закройте пробками. Перед началом опыта проверьте прибор на герметичность. Убедившись, что прибор герметичен, приведите давление внутри прибора к атмосферному. Зафиксируйте нулевое деление. Затем пробирку Оствальда поверните таким образом, чтобы кислота перелилась в колено с цинком. Фиксируйте объем выделившегося водорода в течение 10–15 минут.
Результаты опыта внесите в таблицу 5.6
Таблица 5.6
Объем выделившегося водорода, мл
H2SO4
H2SO4 + уротропин
б) Вымойте пробирку Оствальда и проведите аналогичные измерения скорости коррозии цинка при добавлении 2мл 1% раствора уротропина к раствору серной кислоты. Результаты внесите в таблицу 5.6.
Вопросы и задания
Сделайте выводы о влиянии уротропина на скорость коррозии цинка.
5.4.5 Что должен предоставить студент преподавателю для сдачи работы
5.5 Задачи
- в 0,01 М растворе сульфата цинка,
- по отношению к хлорсеребряному электроду
- в насыщенном растворе гидроксида цинка
- с инертными электродами
- с растворимым медным электродом
1. Тепловые эффекты химических реакций
Перед началом работы проверьте правильность подключения соединительных кабелей калориметрической установки (рис.1):
- датчик температуры и нагреватель (двойной черный провод) подключаются через общий разъем ((7) рис. 2.2) к верхнему правому разъему (на рисунке слева) блока питания (номер на разъеме должен совпадать с номером на нижней крышке измерительного преобразователя «ЭКСПЕРТ-001-3»).
- Блок питания (нижний правый разъем — на рисунке слева) подключается к измерительному преобразователю «ЭКСПЕРТ-001-3» (нижний правый разъем — на рисунке слева) посредством короткого соединительного кабеля.
- Магнитная мешалка присоединяется к блоку питания (левый верхний разъем — на рисунке справа).
- Блок питания подключается к розетке 220 В.
- измерительный преобразователь «ЭКСПЕРТ-001-3» (левый нижний разъем — на рисунке справа) соединяется кабелем с компьютером (разъем на стойке лабораторного стола)
- перед началом работы калориметрической установки включите компьютер,
- загрузите Windows,
- загрузите программу «Expert-001» посредством нажатия правой клавиши мыши при положении курсора на соответствующем окне экрана монитора.
- Если к компьютеру подключены две калориметрических установки программу «Expert-001» необходимо загрузить дважды.
- В появившемся окне программы «Expert-001» последовательно выполните команды «ВИД» – «ПАРАМЕТРЫ» – «ПОРТ».
- Выберите при работе с двумя установками для одной порт «СОМ1», для другой порт «СОМ2».
- Выполните команду «График».
- После начала работы калориметрической установки выполните команду «СТАРТ» в меню программы измерения данных на компьютере.
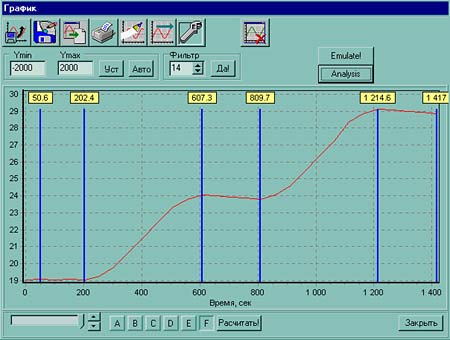
Рис.1. Калориметрическая установка. Вид сзади. Схема подключения кабелей.
Если измерительный преобразователь «ЭКСПЕРТ-001-3» подключен к компьютеру, то:
- После того, как экспериментальный график будет построен, распечатайте его для студента — для этого выполните команду «настройка» — (окошко с гаечным ключом), отметьте галочкой в окошке «практикум по общей химии», выполните команду «да». Затем выполните команду «принтер». В появившемся окне «Комментарий» заполните графы «Студент» (можно указать фамилию и группу) и «Комментарий». Выполните команду «ок». После этого выполните команду «принтер». Полученный график еще раз проверьте и выполните команду «печать».
- После того, как график будет распечатан, можно провести обсчет кривой и получить результат по определению величины энтальпии процесса. Для этого нажмите на кнопку «Analysis» и переставляя вертикальные маркеры определите положения касательных к кривой, затем выполните команду «рассчитать» и в следующем программном окне установите основные начальные данные напряжение 12 В, сопротивление 13,33 Ом, объем раствора НСl — 150 мл, концентрация НСl, затем еще раз выполните команду «рассчитать» и получите результат по определению величины энтальпии процесса.
- Выполните команду «Стоп»
Анализатор для определения рН состоит из измерительного преобразователя и комбинированного стеклянного электрода, чувствительного к концентрации (точнее к активности) ионов водорода.
Прибор позволяет определить значения рН исследуемых растворов с точностью ±0,05.
Ионометрическое измерение рН раствора производится в режиме «рН-метр-иономер» и включает следующие этапы:
- Подготовка прибора к работе
- Выбор измеряемого иона;
- Калибровка по стандартным растворам (ввод в память анализатора параметров стандартных растворов);
- Просмотр внесенных в память прибора градуировок.
- Измерение рН.
- Окончание работы
Подготовка прибора.
Перед началом работы подключите комбинированный электрод к измерительному входу прибора. Обязательно промойте электрод, несколько раз опустив его в стаканчик с дистиллированной водой. Осушите его фильтровальной бумагой. Будьте осторожны — электрод хрупкий!
Откройте отверстие в верхней части электрода, опустив резиновое кольцо немного ниже.
2. Выбор измерительного иона. Включите анализатор, нажав кнопку » ВКЛ» и не отпуская ее несколько секунд).
Обратите внимание на % зарядки аккумулятора (АКК = N%), величина которого не должна быть меньше 30%.
| На дисплее появится: | Выбор режима |
| Через несколько секунд появится надпись | рН- метр- ионометр |
| После этого нажмите кнопку «ИОН» и кнопками » « выберите рН | рН |
| Нажмите кнопку «ВВОД» | |
| На дисплее появится: | рН- метр- ионометр |
| После этого приступайте к калибровке прибора. |
В 4 стаканчика на 50 мл налейте по 30 мл буферных растворов с рН 918, 6.86, 4.01, 1.65 соответственно. Опустите электрод в стаканчик с буферным раствором 9.18 (калибровку надо начинать с раствора с большим рН + , последовательно переходя к растворам с меньшим рН). Измерение проводите, погрузив электрод в раствор не менее чем на 30 мм. Электрод не должен касаться дна и стенок стакана!
| Нажмите «КЛБ» . На дисплее появится надпись | х.ххх рХ рН хххх.х мВ n1 |
| Нажмите кнопку «N» на дисплее появится | Число точек |
| Установите количество точек калибровки «4» кнопками » » и нажмите «ВВОД». На дисплее появится | х.ххх рХ рН хххх.х мВ n1 |
| Нажмите кнопку «ЧИСЛ». На дисплее появится | Введите число |
| Наберите на клавиатуре число 9.18 и нажмите | «ВВОД». |
| Появится запрос | Ввод изменения? Да — ВВОД Нет — ОТМ |
| Нажмите «ВВОД». Появится надпись | 9.18 рХ рН хххх.х мВ n1 |
| Нажмите «ИЗМ». Появится надпись | |
| Начинается измерение э.д.с. и отсчет времени. После того как значение э.д.с. установится (будет изменяться не более чем ± 1,5 мВ/мин), но не раньше, чем через 1, минуту нажмите кнопку «ВВОД» | |
| На дисплее появится запрос | Ввод изменения? Да — ВВОД нет — ОТМ |
| Нажмите «ВВОД». Появится надпись | 9.18 рХ рН хххх.х мВ n1 |
После измерения выньте электрод из измеряемого раствора, промойте дистиллированной водой и осушите его фильтровальной бумагой.
Далее электрод поместите в стаканчик со следующим раствором с рН 6.86.
Перейдите ко второй точке калибровки. Для этого кнопкой «>» установите на дисплее окно с обозначением n2 в нижней строке.
Калибровка по второму и остальным стандартным растворам проводится так же как и для первого стандартного раствора.
После окончания калибровки нажмите кнопку «ОТМ»
| На дисплее появится надпись |
4. Просмотр внесенных в память прибора градуировок.
Для просмотра ранее внесенных в память измерительного прибора калибровок, нажмите кнопку «ИОН» и кнопками » « выберите «рН». Нажав кнопку «ВВОД» выйдите в режим рН-метр-иономер
Нажмите кнопку «КЛБ». На дисплее появится значение первой точки калибровки. С помощью кнопки «>» можно просмотреть все следующие точки.
| По окончании просмотра нажмите «ОТМ» на дисплее появится | Выбор режима рН-метр-иономер |
| 5. Измерение рН растворов. | |
| Выберите режим работы | рН-метр-иономер |
| Нажмите кнопку «ИОН» и кнопками » «выберите рН. | |
| Нажмите кнопку «ВВОД» и выйдите в режим рН-метр-иономер | |
| Опустите подготовленный электрод в испытуемый раствор, нажмите кнопку «ИЗМ». На дисплее появится | |
и начнется измерение э.д.с. и отсчет времени измерения. Если на дисплее появляется значение э.д.с. в мВ, а не величина рН испытуемого раствора, нажмите кнопку «рХ». После окончания измерения рН испытуемого раствора нажмите кнопку «ОТМ», вы снова выйдите в режим рН-метр-ионом
6. Окончание работы.
По окончании работы прибор необходимо отключить кнопкой «ОТКЛ», промыть электрод дистиллированной водой, высушить фильтровальной бумагой и поместить в стаканчик с буфером 4.01.
Зависимость электродного потенциала от концентрации
Анализ уравнения Нернста показывает, что даже при достаточно большом изменении (уменьшении или увеличении) концентраций компонентов по сравнению с единичными значениями новая величина φ будет мало отличаться от стандартного значения электродного потенциала(φ˚).
Это приводит к важному выводу:
–если в окислительно-восстановительной реакции разность ∆Е° = φ°ок – φ°вс велика, то даже при больших изменениях концентраций окислителя и восстановителя их окислительно-восстановительные потенциалы (φок и φвс)будут мало отличаться от соответствующих стандартных значений и новая разность ∆E будет мало отличаться от исходной ∆Е°, т. е. концентрационные эффекты практически не изменяют природу окислительно-восстановительного процесса в целом;
–если в ОВР разность ∆Е° =φ°ок – φ°вc мала, то при больших изменениях концентраций окислителя и восстановителя новая разность ∆Е будет относительно сильно (вплоть до перемены знака) отличаться от исходной ∆Е°и в этом случае можно ожидать существенного влияния концентрационных эффектов на природу окислительно-восстановительного процесса в целом.
Особенно ярко концентрационные эффекты проявляются в тех случаях, когда концентрация одного из участников окислительно-восстановительного процесса уменьшается на много порядков. К таким явлениям приводит образование малорастворимых соединений или устойчивых комплексных ионов.
Уменьшение концентрации окисленной формы приводит к понижению потенциала электрода, следовательно, к снижению окислительной способности. Например, окислительная способность следующих форм кобальта
уменьшается в соответствии со значениями φ˚, которые составляют (–0,277) В, (–0,42)В,(–0.64)B, (–0,73)В.Образование малорастворимых соединений и комплексов повышает восстановительную способность металлов. Например, золото не растворяется в воде, но легко растворяется в присутствии цианида калия, так как φAu+/Au= +1,69 В, a φ[Au(CN)2] — /Au== – 0,61 В.
Уравнение Нернста.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Значение электродного потенциала можно определить уравнением Нернста:
где [ок] – произведение концентраций компонентов окисленной формы в соответствующих степенях; [вс] – произведение концентраций компонентов восстановленной формы также в соответствующих степенях, φ – электродный потенциал, φ˚ — стандартный электродный потенциал (Вт), 

Зависимость электродного потенциала от концентрации уравнение нернста
4.2. ОСНОВНЫЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПОТЕНЦИАЛ
Рассчитанный по уравнению Нернста равновесный потенциал зависит прежде всего от соотношения концентраций окисленной и восстановленной форм рассматриваемой полуреакции: увеличение концентрации окисленной формы, также как уменьшение концентрации восстановленной формы, приводит к возрастанию потенциала. Однако эти изменения потенциала сравнительно невелики. Например для n =1 увеличение концентрации окисленной формы в 1000 раз приводит к изменению потенциала на (0,059/ n ) lg 1000 ≈ 0,188В.
Во многих окислительно-восстановительных реакциях участвуют ионы водорода (гидроксония)
Cr 2 O 7 2- +14 H + + 6 e — = 2 Cr 3+ + 7 H 2 O .
Для полуреакции в общем виде имеем:
В соответствии с уравнением Нернста потенциал выражается следующим образом:
Отсюда видно, что изменение концентрации ионов водорода в процессе химического взаимодействия вносит существенный вклад в изменение потенциала окислительно-восстановительной системы.
В тех случаях, когда в окислительной или восстановительной полуреакции ионы водорода не принимают непосредственного участия, они могут влиять на состояние ионов окисленной и восстановленной форм в растворе, тем самым изменяя потенциал.
Значение рН среды иногда определяет возможность осуществления окислительно-восстановительной реакции и использование ее в аналитической химии. Например, в зависимости от кислотности раствора реальный потенциал восстановления перманганата принимает следующие значения: рН =0, Е=1,51 В; рН=3, Е=1,23 В; рН=6, Е=0,93 В. Учитывая это, можно использовать перманганат калия для дифференцированного окисления следующих окислительно-восстановительных систем: Е ° С l 2/2 Cl — = 1,36 В; Е ° Br 2/2 Br — = 1,09 В ; Е ° I 2/2 I — =0,54 В. При рН =6 окисляется только I — , при рН=3 – I — и Br — , тогда как при рН=0 окислить можно все три иона.
На значение потенциала существенное влияние оказывают любые побочные химические процессы, в которых участвуют окисленная и восстановленная формы. Часто такими процессами являются реакции комплексообразования, при которых возможно существование в растворе ряда комплексных соединений. Обычно наиболее склонна к реакциям комплексообразования окисленная форма, в результате чего потенциал системы и окислительные свойства уменьшаются. Эту зависимость потенциала от концентрации комплесообразующего реагента широко используют в аналитической практике для регулирования окислительно-восстановительных свойств различных систем. Например, при титровании раствора, содержащего ионы Fe 2+ , раствором бихромата калия в присутствии дифениламина комплексообразование используется для снижения индикаторной ошибки.
Изменение стандартного (реального) потенциала вследствие реакции комплексообразования используют для стабилизации в растворе ионов металлов. Например, некоторые неорганические лиганды стабилизируют ионы Fe 3+ , а органические лиганды – ионы Fe 2+ .
Как следует из уравнения Нернста, потенциал системы зависит от температуры (предлогарифмический множитель). Наиболее существенно влияние температуры на потенциал окислительно-восстановительных систем, включающих гетерогенную фазу. Кроме того, значительное влияние температура оказывает на скорость окислительно-восстановительных реакций.
http://lektsii.org/3-77264.html
http://www.chem-astu.ru/chair/study/anchem/r_4_2.htm