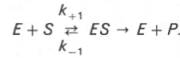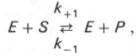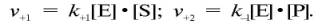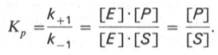Влияние концентраций субстрата и фермента на скорость ферментативной реакции
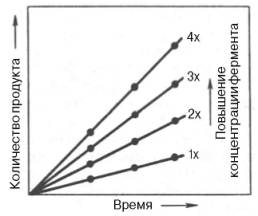
Из приведенного ранее материала вытекает важное заключение: одним из наиболее существенных факторов, определяющих скорость ферментативной реакции, является концентрация субстрата (или субстратов) и продукта (продуктов). При постоянной концентрации фермента скорость реакции постепенно увеличивается, достигая определенного максимума (см. рис. 4.12, 4.13), когда дальнейшее увеличение количества субстрата практически не оказывает влияния на скорость ферментативной реакции. В таких случаях принято считать, что субстрат находится в избытке, а фермент полностью насыщен, т.е. все молекулы фермента связаны с субстратом. Ограничивающим скорость реакции фактором в последнем случае становится концентрация фермента. Именно при этих условиях определяют величину максимальной скорости (Vmax) и значения константы Михаэлиса (Km) (см. рис. 4.13; 4.14).
Рис. 4.19. Зависимость скорости реакции от концентрации фермента в присутствии насыщающих концентраций субстрата.
Скорость любой ферментативной реакции непосредственно зависит от концентрации фермента (рис. 4.19). Существующая линейная зависимость между этими величинами, когда скорость реакции прямо пропорциональна количеству присутствующего фермента, справедлива только в определенных условиях, например в начальный период ферментативной реакции, так как в этот период практически не происходит обратной реакции, а концентрация продукта оказывается недостаточной для обратимости реакции.
Именно в этом случае скорость реакции (точнее, начальная скорость реакции v) будет пропорциональна концентрации фермента. Как было отмечено, фермент является одной из реагирующих молекул в химической реакции и при взаимодействии с субстратом образует промежуточный фермент-субстратный комплекс, который далее подвергается распаду на продукт и свободный фермент:
Если упростить это уравнение, исключив промежуточный ES-комплекс:
то в уравнениях для скоростей прямой и обратной реакций обязательным компонентом является концентрация фермента:
Как видно, константа равновесия (Kр) ферментативной реакции не зависит от концентрации фермента. Определяя скорость и направление химической реакции, фермент тем не менее не оказывает влияния на конечные (равновесные) концентрации реагирующих молекул и продуктов, определяющих величину константы равновесия.
БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ — Е. С. Северина — 2004
РАЗДЕЛ 2. ЭНЗИМОЛОГИЯ
V. Основы кинетики ферментативных реакций
Кинетика ферментативных реакций — раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ, а также от факторов окружающей среды.
Для измерения каталитической активности ферментов используют такие показатели, как скорость реакции или активность фермента. Скорость ферментативной реакции определяется изменением количества молекул субстрата или продукта за единицу времени. Скорость ферментативной реакции — мера каталитической активности фермента, её обозначают как активность фермента.
Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени:
На начальном этапе [0 — t0] скорость реакции прямо пропорциональна времени и имеет линейную зависимость. Графически изменение скорости ферментативной реакции определяется тангенсом угла наклона касательной к кривой профиля реакции. Чем больше угол наклона, тем больше изменение скорости реакции (рис. 2-15).
Рис. 2-15. Зависимость накопления продукта (А) и убыли субстрата (Б) от времени (продолжительности) протекания реакции. Скорость ферментативной реакции определяется изменением концентрации продукта или субстрата за единицу времени. В реакциях, катализируемых ферментами 1 и 2, начальная скорость реакции, катализируемой ферментом 1, ниже, чем скорость реакции, катализируемой ферментом 2, так как тангенс угла наклона касательной к кривой профиля реакции, проведённой из «0» точки у второго фермента выше, как в случае накопления продукта (А), так и убыли субстрата (Б). Скорость в любой момент времени t определяется тангенсом угла наклона касательной к профилю реакции в момент времени t. Период времени ферментативной реакции [t0 — t1] характеризуется линейным накоплением продукта (или убылью субстрата) в зависимости от длительности реакции. Период ферментативной реакции [t1 — tx] характеризуется нелинейным накоплением продукта (или убылью субстрата) в зависимости от времени реакции.
С течением времени изменение скорости ферментативной реакции в экспериментальных условиях уменьшается, об этом свидетельствует уменьшение угла наклона касательной в момент времени 1. Снижение скорости ферментативной реакции может происходить за счёт ряда факторов: уменьшения концентрации субстрата, увеличения концентрации продукта, который может оказывать ингибирующее действие, могут происходить изменения pH раствора, инактивация фермента и т. д.
На этапе [t1— tx] скорость реакции изменяется нелинейно в зависимости от времени. Поэтому для определения скорости ферментативной реакции чаще всего исследуют изменение скорости на начальном этапе [t0 — t1], где наблюдают линейное изменение концентрации продукта (или субстрата).
Скорость ферментативной реакции зависит от ряда факторов, таких как количество и активность ферментов, концентрация субстрата, температура среды, pH раствора, присутствие регуляторных молекул (активаторов и ингибиторов). Рассмотрим влияние этих факторов на скорость ферментативной реакции.
А. Зависимость скорости ферментативной реакции от количества ферментов
При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Графическая зависимость такой реакции имеет вид прямой линии (рис. 2-16). Однако количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (МЕ) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, pH раствора, при отсутствии активаторов и ингибиторов.
Рис. 2-16. Зависимость скорости ферментативной реакции (V) от концентрации фермента.
Количество единиц активности nМЕ определяют по формуле:
В 1973 г. была принята новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с. Количество каталов определяют по формуле:
Международная единица ферментативной активности МЕ связана с каталом следующими равенствами:
1 кат = 1 моль S/с = 60 моль S/мин = 60 х 10 6 мкмоль/мин = 6 х 10 7 МЕ,
1 МЕ = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат.
В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности — МЕ. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (nМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани:
По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность.
Б. Зависимость скорости ферментативной реакции от температуры среды
Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы (рис. 2-17).
Рис. 2-17. Зависимость скорости ферментативной реакции (V) от температуры.
Для большинства ферментов человека оптимальна температура 37— 38 °С. Однако в природе существуют и термостабильные ферменты. Например, Taq — полимераза, выделенная из микроорганизмов, живущих в горячих источниках, не инактивируется при повышении температуры до 95 °С. Этот фермент используют в научно- практической медицине для молекулярной диагностики заболеваний с использованием метода полимеразной цепной реакции (ПЦР).
В. Зависимость скорости ферментативной реакции от рН среды
Активность ферментов зависит от pH раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение pH, при котором наблюдается его максимальная активность. Отклонение от оптимального значения pH приводит к понижению ферментативной активности.
Влияние pH на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении pH от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3 + ), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО — ). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, pH среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения pH может происходить денатурация белковой молекулы с полной потерей ферментативной активности.
Оптимум значения pH у разных ферментов различный (рис. 2-18). Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях pH. Однако большая часть ферментов организма человека имеет оптимум pH, близкий к нейтральному, совпадающий с физиологическим значением pH (табл. 2-1).
Таблица 2-1. Оптимальные значения pH для некоторых ферментов
Зависимость изменения скорости ферментативной от концентрации описывает уравнение
Во многих случаях скорость реакции резко изменяется в присутствии специальных веществ — катализаторов. Катализаторы участвуют в реакции, но в результате ее не расходуются. Катализаторы биологических процессов, протекающих в живых организмах, представляют собой белковые молекулы, которые называют ферментами, или энзимами.
Простейшая схема ферментативного катализа включает обратимое образование промежуточного комплекса фермента (E) с реагирующим веществом (субстратом, S) и разрушение этого комплекса с образованием продуктов реакции (P):
Применение квазиравновесного приближения к этой схеме (при условии k2 > k1). Применение этого метода к простейшей схеме катализа дает уравнение Михаэлиса-Ментен:

где wmax = k2 . [E]0 — максимальная скорость реакции (при бесконечно большой концентрации субстрата),
— константа Михаэлиса. Эта константа равна концентрации субстрата, при которой скорость реакции равна половине максимальной скорости. Типичные значения KM — от 10 -6 до 10 -1 моль/л. Константу скорости k2 иногда называют числом оборотов фермента. Она может изменяться в пределах от 10 до 10 8 мин -1 .
Уравнение (7.2) можно записать в других координатах, более удобных для обработки экспериментальных данных:

(координаты Лайнуивера-Берка) или

Для определения параметров KM и wmax по уравнениям (7.2а) и (7.2б) проводят серию измерений начальной скорости реакции от начальной концентрации субстрата и представляют экспериментальные данные в координатах 1/w0 ё 1/[S]0 или w0 ё w0/[S]0.
Иногда течение ферментативной реакции осложняется присутствием ингибиторов — веществ, способных образовывать комплексы с ферментом или фермент-субстратным комплексом. Различают конкурентное, неконкурентное и смешанное ингибирование.
При конкурентном механизме ингибитор (I) конкурирует с субстратом за активные участки фермента. Простейшая кинетическая схема данного процесса имеет вид:
Применение квазистационарного приближения к комплексу ES и квазиравновесного приближения к комплексу EI с учетом уравнений материального баланса [E] + [ES] + [EI] = [E]0 и [I] » [I]0 дает для скорости реакции уравнение типа (7.2):

где эффективная константа Михаэлиса связана с исходной концентрацией ингибитора:

Величину KI = [E]. [I] / [EI], которая представляет собой константу диссоциации комплекса фермента с ингибитором, называют константой ингибирования. Таким образом, при конкурентном ингибировании увеличивается константа Михаэлиса, а максимальная скорость ферментативной реакции остается неизменной.
При неконкурентном механизме ингибитор обратимо связывает промежуточный комплекс фермента с субстратом. Простейшая кинетическая схема данного процесса имеет вид:

где предполагается, что константы диссоциации комплексов EI и ESI одинаковы: [E]. [I] / [EI] = [ES]. [I] / [ESI] = KI. Применение квазистационарного приближения к комплексу ES и квазиравновесного приближения к комплексам EI и ESI с учетом уравнений материального баланса [E] + [ES] + [EI] + [ESI] = [E]0 и [I] » [I]0 дает для скорости реакции уравнение типа (7.2):

где эффективная максимальная скорость связана с начальной концентрацией ингибитора выражением:

При неконкурентном ингибировании максимальная скорость реакции уменьшается, а константа Михаэлиса остается неизменной.
Смешанное ингибирование описывается более сложными кинетическими схемами. При смешанном ингибировании изменяются и константа Михаэлиса, и максимальная скорость ферментативной реакции.
Пример 7-1. Найдите константу Михаэлиса и максимальную скорость гидролиза аденозинтрифосфата, катализируемого миозином, по следующим кинетическим данным:
Решение. Уравнение Михаэлиса-Ментен в данных координатах имеет вид (7.2б), следовательно, точки пересечения с осями имеют координаты: (0;wmax) для оси ординат, (wmax/KM;0) для оси абсцисс. Первая точка пересечения дает значение wmax = 2.1 . 10 -6 моль/(л. с). Вторая точка позволяет найти константу Михаэлиса: wmax/KM = 14.6 . 10 -3 с -1 , KM = 2.1 . 10 -6 / 14.6 . 10 -3 = 1.44 . 10 -4 моль/л.
Пример 7-2. Ферментативная реакция (KM = 2.7 . 10 -3 моль/л) подавляется конкурентным ингибитором (KI = 3.1 . 10 -5 моль/л). Концентрация субстрата равна 3.6 . 10 -4 моль/л. Сколько ингибитора понадобится для подавления реакции на 65%? Во сколько раз надо повысить концентрацию субстрата, чтобы уменьшить степень подавления до 25%?
Решение. 1) Конкурентное ингибирование описывается формулами (7.3) и (7.3а). 65%-ное подавление реакции означает, что скорость ингибируемой реакции составляет 35% от скорости реакции в отсутствие ингибитора:

откуда следует, что

В этой формуле известны значения KM, KI и [S]. Концентрация ингибитора равна:

Уменьшение степени ингибирования до 25% означает, что скорость ингибируемой реакции составляет 75% от нормальной:

где в данном случае известны KM, KI и [I]0. Отсюда можно выразить искомую концентрацию субстрата:

Таким образом, для уменьшения степени ингибирования до 25% концентрацию субстрата надо увеличить в 1.4 . 10 -2 / 3.6 . 10 -4 = 40 раз.
7-1. Гидролиз ацетилхолина катализируется ферментом ацетилхолинэстеразой, число оборотов которой составляет 25000 с -1 . Сколько времени потребуется ферменту для расщепления одной молекулы ацетилхолина? (ответ)
7-2. Для некоторой ферментативной реакции константа Михаэлиса равна 0.035 моль/л. Скорость реакции при концентрации субстрата 0.110 моль/л равна 1.15 . 10 -3 моль/(л. с). Найдите максимальную скорость этой реакции.(ответ)
7-3. Начальная скорость окисления сукцината натрия в фумарат натрия под действием фермента сукциноксидазы была измерена для ряда концентраций субстрата:
0.0005
0.00033
Определите константу Михаэлиса данной реакции.(ответ)
7-4. Начальная скорость выделения O2 при действии фермента на субстрат была измерена для ряда концентраций субстрата:
0.002
Определите константу Михаэлиса данной реакции.(ответ)
7-5. Найдите константу Михаэлиса и максимальную скорость каталитического разложения гидроперекиси тетралина по следующим кинетическим данным:
7-6. Найдите константу Михаэлиса и максимальную скорость каталитического окисления циклогексена трет-бутилпероксидом по следующим кинетическим данным:
7-7. Найдите константу Михаэлиса и максимальную скорость гидролиза карбобензилоксиглицилфенилаланина под действием карбоксипептидазы по следующим кинетическим данным:
7-8. Рассчитайте концентрацию неконкурентного ингибитора I (KI = 2.9 . 10 -4 моль/л), необходимую для 90%-ного подавления ферментативной реакции.(ответ)
7-9. В некоторых случаях кинетические исследования ферментативных реакций проводят в условиях избытка фермента. Выведите уравнение Михаэлиса-Ментен, описывающее зависимость начальной скорости ферментативной реакции от начальных концентраций фермента и субстрата в системе
при условии, что концентрация фермента намного больше концентрации субстрата.(ответ)
*7-10. Рассмотрите механизм ферментативного катализа с двумя промежуточными комплексами:
Используя метод квазистационарных концентраций и уравнение материального баланса, покажите, что скорость реакции описывается уравнением типа Михаэлиса-Ментен (7.2). Найдите выражения для эффективной максимальной скорости и эффективной константы Михаэлиса через константы скорости отдельных стадий.(ответ)
7-11. Запишите уравнения конкурентного и неконкурентного ингибирования в координатах Лайнуивера-Берка. Представьте эти уравнения в графическом виде для трех разных начальных концентраций ингибитора (включая [I]0 = 0). Объясните, как можно определить константу ингибирования.(ответ)
7-12. Запишите уравнения конкурентного и неконкурентного ингибирования в координатах w0 
*7-13. Рассмотрите схему неконкурентного ингибирования с разными константами диссоциации комлпексов:
Используя квазистационарное приближение для ES и квазиравновесное приближение для EI и ESI, найдите начальную скорость реакции. Как связаны максимальная скорость реакции и константа Михаэлиса с соответствующими величинами для неингибируемой реакции?(ответ)


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
http://lifelib.info/biochemistry/biochemistry_4/14.html
http://www.chemnet.ru/rus/teaching/eremin/7.html