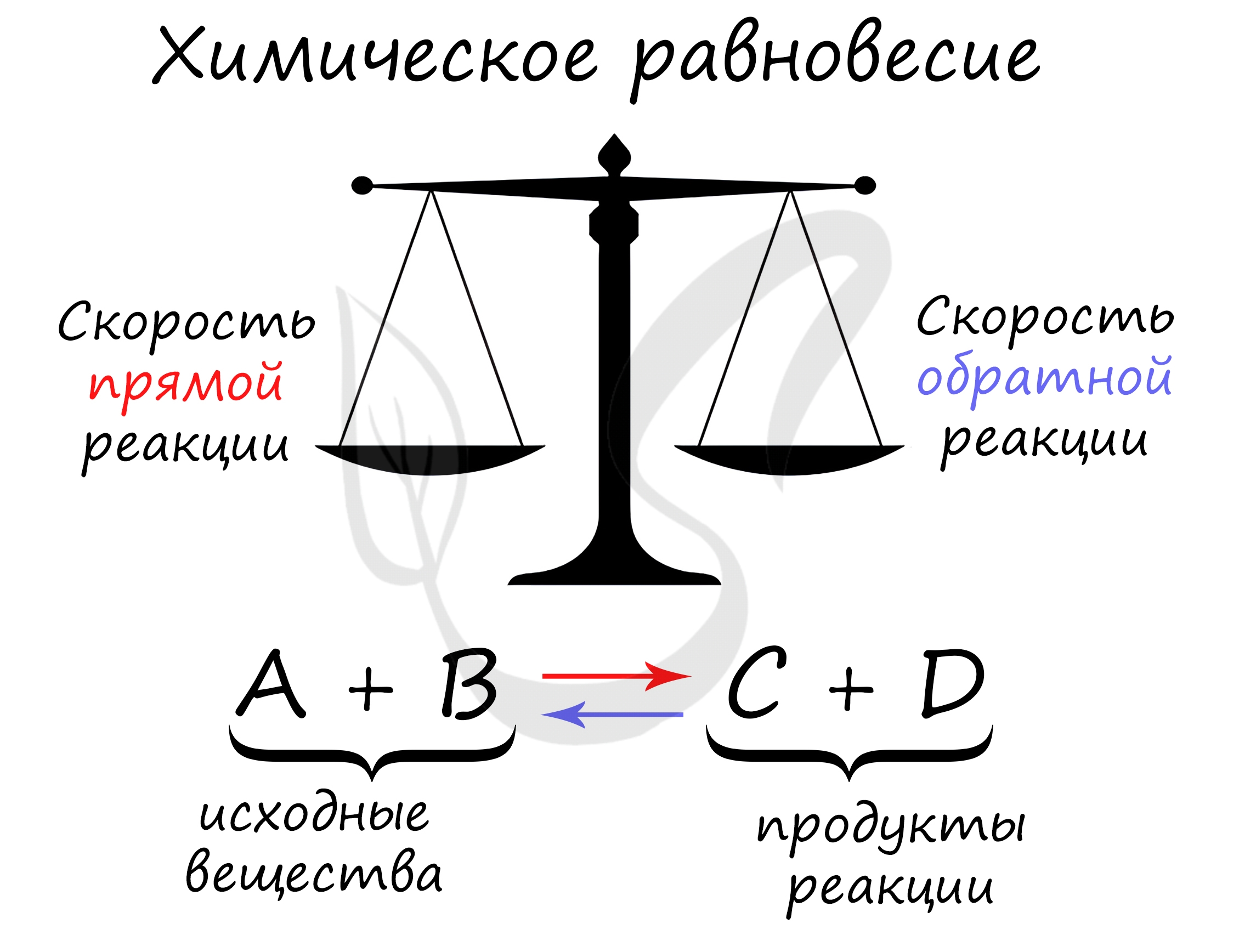
Химическое равновесие
Химическое равновесие — состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно предлагают похожий вариант, однако говорят о «равенстве концентраций исходных веществ и продуктов» — это грубая ошибка. Химическое равновесие — равенство скоростей.
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
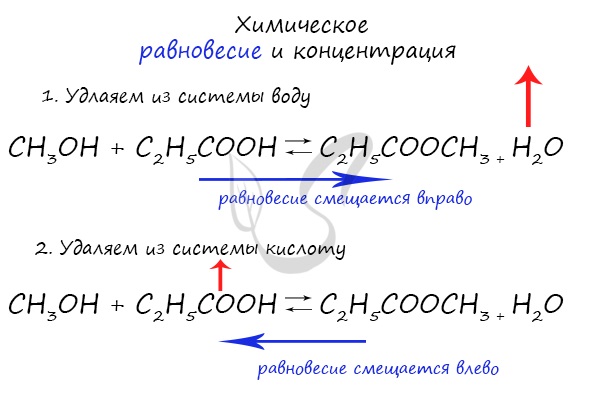
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону. Если добавляете вещество из левой части (продуктов реакции) — смещается в сторону исходных веществ. Посмотрите на пример ниже.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Можно подвести итог полученным знаниям таким образом: «Куда добавляем — оттуда смещается, откуда берем — туда смещается». Воспользуйтесь этой или придумайте свое правило для запоминания этой закономерности 😉
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В приведенном уравнении количество молекул газа в левой части — 1, в правой — 2.
Запомните правило: «При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления — в сторону больших газов». Для нашей системы правило действует таким образом:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Слева — 2 газа, и справа — 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
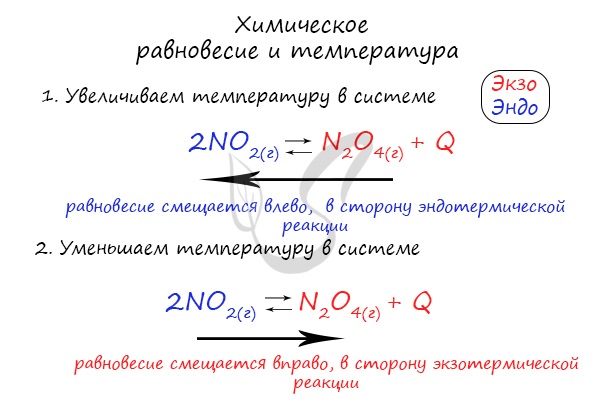
Изменение температуры и химическое равновесие
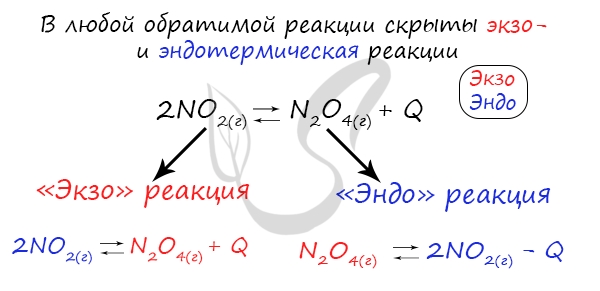
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Следуйте следующему правилу: «При увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении — в сторону экзотермической реакции». У любой обратимой реакции есть экзо- и эндотермические части:
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.
Константу равновесия для данной задачи можно представить в виде 1.64 * 10 -1 .
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химическое равновесие. Принцип Ле Шателье
Материалы портала onx.distant.ru
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Константа химического равновесия
Для химической реакции:
константа химической реакции Кс есть отношение:
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGT о = – RTlnK (2)
Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
Вещество
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
Решение.
ΔG298 о = 2·(- 16,71) кДж = -33,42·10 3 Дж.
lnK = 33,42·10 3 /(8,314× 298) = 13,489. K = 7,21× 10 5 .
Задача 3. Определите равновесную концентрацию HI в системе
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х) 2 /((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔН о Т » ΔН о 298, а ΔS о T » ΔS о 298.
Решение.
Если К = 1, то ΔG о T = — RTlnK = 0;
ΔН о 298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 10 3 Дж;
ΔS о 298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества
газообразных веществ, то равновесие сместится вправо в реакции 3.
2. При некоторой температуре равновесные концентрации в системе:
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
К = 4; исходная концентрация HBr составляет 1,5 моль/л.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
[H2] = 0,5 моль/л; [S] = 1,5 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
становится равной 1. Примите, что ΔН о Т≈ΔН о 298, а ΔS о T≈ΔS о 298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
равна 3,4·10 -5 . Вычислите Δ G о 500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔG о f,800(С3Н6(г)), если ΔG о f,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л;
исходная концентрация О2 составляет 0,20 моль/л.
Зависимость константы химического равновесия от температуры определяется уравнением
Большинство химических реакций протекают одновременно в двух направлениях: в сторону образования продуктов реакции (прямая реакция) и в сторону разложения последних (обратная реакция). Вследствие химической обратимости реакции не доходят до конца. Скорость прямой реакции уменьшается, а скорость обратной, напротив, возрастает. Когда эти скорости выравниваются наступает состояние химического равновесия.
Так как химически обратимые реакции до перехода в равновесное состояние протекают с конечными скоростями, то с точки зрения термодинамики они не обратимы. Однако можно мысленно представить, что эти реакции идут бесконечно медленно через смежные равновесные состояния. Тогда к ним можно применить общие условия термодинамического равновесия.
Для гомогенных обратимых реакций экспериментально Гульбергом и Ваге был установлен закон действующих масс. При постоянной температуре отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции к произведению равновесных концентраций (или парциальных равновесий) исходных веществ есть величина постоянная.
Этот экспериментально установленный закон может быть получен методом термодинамических потенциалов. Рассмотрим реакцию в газовой фазе:
аА(г) + b В ↔ сС + dD
Когда система достигает термодинамического равновесия, то термодинамический потенциал при фиксированных естественных переменных достигает минимума. Равновесие, таким образом, можно охарактеризовать выражением химических потенциалов, когда потенциалы продуктов реакции сравняются с потенциалами исходных веществ:
с μ ( с ) + d μ (D) – a μ (a) — b μ (b) = 0 (6 – 1)
Если естественными переменными являются p и T , то 


Отсюда для систем, подчиняющихся закону идеальных газов, можно получить выражения для μ i
μ i = μ i ° + RTlnCi (6 – 2) 
где μ i ° — стандартный химический потенциал.
Подставляется (6 – 2) в (6 – 1) и перенося постоянные величины в левую часть, получаем
сμ C ° + d μ D ° — a μ A ° — b μ B ° = — RTln 

Поскольку в левой части выражение не зависит от концентраций, то выражение под логарифмом является постоянной величиной при постоянной температуре:

Для идеального газа парциальные давления пропорциональны концентрациям, поэтому константа равновесия может быть всегда выражена через равновесные парциальные давления:
Аналогично может быть записано выражение через мольные доли:
Для идеальных газов эти константы связаны между собой соотношением:
где
Следует обратить внимание, что в полученных соотношениях только KN зависит от общего давления. Она позволяет нам оценивать сдвиг равновесия в газовых реакциях при изменении общего давления. Следует иметь в виду, что давление в этих выражениях складывается из парциальных давлений компонентов системы и не учитывает влияние инертных газов, если они присутствуют в реакционной смеси. Естественно инертный газ «разбавляет» компоненты реакционной смеси и поэтому влияет на KN .
Из уравнения (6 – 3) вытекает связь константы равновесия с ∆ rG °:

Это уравнение было впервые получено Вант – Гофором методом циклов и получило название уравнения изотермической химической реакции. Очевидно, в этом уравнении ∆ rGT ° относится к этой температуре, при которой определена Кр. Уравнение изотермической химической реакции позволяет определить константу равновесия при заданных условиях не прибегая к исследованию равновесия. Величина ∆ rGT ° может быть рассчитана на основе термических констант для индивидуальных веществ.
Если заданы концентрации (парциальные давления) отличные от равновесных, то можно записать более общий вид уравнения изотермической химической реакции:
Это выражение позволяет определить направление самопроизвольного процесса.
Уравнение изотермы химической реакции позволяет получить выражение для температурной зависимости константы равновесия.
Запишем уравнение Гиббса – Гельмгольца:
Подставим выражение для 

Дифференцируем уравнение (6 – 5)


Из уравнения (6 — 5´) получаем уравнение изобары химической реакции:

Если проинтегрировать уравнение (6 – 6) в предположении, что ∆ rHT ° не зависит от температуры, то получим уравнение:
где С – константа интегрирования.
Уравнение (6 – 7) хорошо выполняется в узких интервалах температур и позволяет определить ∆ rGT °.
Для широких интервалов температур ln K р представляют в виде степенных рядов или других аналитических формах:
Такие выражения позволяют рассчитать все термодинамические функции для процессов, для которых данные зависимости получены.
Выражения для термодинамических потенциалов, полученные для идеального газа. Для реальных газов, а особенно для газовых растворов возникают затруднения. Это связано с тем, что расчет концентраций и давлений должен быть проведен исходя из уравнения состояния. Однако для реальных систем единое достаточно простое уравнение состояния получить не удалось.
В связи с этим в термодинамике реальных систем применяется эмпирический метод, предложенный Льюисом. Льюис предложил в уравнениях термодинамики, полученных для идеальных систем заменить давления p на величину летучести f , а концентрации С на активности a .
При такой замене выражения для констант равновесия не меняются по форме. Но этот прием позволяет связать экспериментально найденные свойства реального газа с термодинамическими параметрами.
Летучести и активности – это экспериментальные величины, которые находятся из условия, что для раствора при бесконечном разбавлении или газа при давлении стремящимся к 0 активность приближается к аналитической концентрации, а летучесть к реальному давлению идеального газа. Исходя из этой посылки рассчитываются активности и летучести.
При 1273 К и общем равновесии 30 атм. В равновесной системе




В соответствии с законом Авогадро, объёмный процент равен мольному проценту. Следовательно, 
Отсюда находим
В отличие от 




Для 25% 
Следовательно,
При 2000°С и общем давлении 1 атм. 2% воды диссоцииовано на водород и кислород. Рассчитайте константу равновесия реакции 
http://chemege.ru/ravnovesie/
http://www.trotted.narod.ru/physchem/lec-6.htm