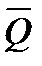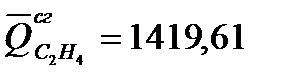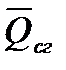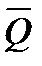Зависимость молярной теплоемкости от температуры выражается уравнением
Многоатомные газы (i = 6):
CV = 4 R = 33,24 Дж/(моль • К);
СР = 3R = 24,93 Дж/(моль • К);
Экспериментальные данные для различных газов неплохо совпадают с теоретическими расчетами, однако только в определенном диапазоне температур.
То, что CV = (3/2) R , хорошо подтверждается на опыте с Ne, He, Ar, Kr, парами одноатомных металлов (рис. 3.4.3).
При температурах ниже 100 К (рис. 3.4.3) теплоемкость CV ≈ 3R/2, что указывает на отсутствие у молекул как вращательных, так и колебательных степеней свободы.
Далее, с ростом температуры теплоемкость быстро возрастает (явление «размораживания» степеней свободы молекулы) до классического значения CV = iR/2 = 5R/ 2, характерного для двухатомной молекулы с жесткой связью, в которой нет колебательных степеней свободы.
При температурах свыше 2000 К теплоемкость обнаруживает новый скачок до значения 7R/2. Этот результат свидетельствует о появлении еще и колебательных степеней свободы.
Все это объясняется специфическими квантовыми эффектами, необъяснимыми с позиции классической физики.
Рис. 3.4.3. Экспериментальная зависимость молярной теплоемкости газов от температуры
Первый и второй закон термодинамики. Термохимия
Теплоемкость веществ
Мерой теплоемкости является количество теплоты, выражаемое в джоулях и поглощаемое веществом при нагревании на 1 К. различают массовую, молярную и объемную теплоемкости веществ.
Массовая теплоемкость с представляет собой количество теплоты, необходимое для нагревания 1 кг вещества на один градус [кДж/(кг ∙ К)].
Под молярной теплоемкостью С понимают количество теплоты, необходимое для нагревания одного киломоля вещества на один градус [кДж/(кмоль ∙ К)]. Молярная и массовая теплоемкости связаны соотношением С = сМ.
Объемная теплоемкость с´ равна количеству теплоты, которое необходимо для нагревания на один градус массы вещества, заключенной в 1 м 3 газа при н. у. [кДж/(м 3 ∙ К)]. Массовая, объемная и молярная теплоемкости связаны между собой соотношениями:
У газов различают теплоемкость при постоянном объеме (изохорную) Сυ, сυ и при постоянном давлении (изобарную) Ср, ср; Ср>Сυ и ср>сυ на величину работы расширения
Для 1 кмоль идеального газа при нагревании его на 1º С при р = constA = R= 8,314 кДж(кмоль ∙ К). Следовательно,
Теплоемкость газов растет с повышением температуры. Исключение составляют лишь одноатомные газы (He, Ne, Arи др.), теплоемкость которых не зависит от температуры. В тепловых расчетах используют или истинные теплоемкости Сист, сист, т. е. теплоемкости веществ при данной температуре, или средней теплоемкости 
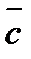
Когда средняя теплоемкость

Истинная теплоемкость Сист является пределом средней теплоемкости, когда разность температур Т2 – Т1 становится бесконечно малой величиной ∆Т:
При расчетах тепловых балансов производственных процессов, как правило, пользуются таблицами величинами средних теплоемкостей веществ от 0 до tº C. Точное значение средней теплоемкости для любых пределов температуры вычисляют, используя математическую зависимость истиной теплоемкости (массовой, молярной и др.) от температуры. Эта зависимость выражается степенными рядами двух видов:
Сист = 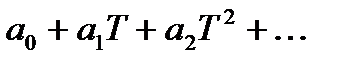
Сист = 
где 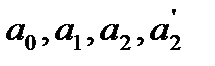
При расчетах обычно ограничиваются двумя-тремя членами этих рядов. Из формулы вытекает dQ=СистdТ. При повышении температуры от Т1 до Т2 количество поглощаемой теплоты вычисляют интегрированием:Q = 
Q = 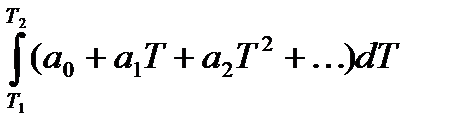
Из формулы можно определить то же количество теплоты Q, учитывая среднюю теплоемкость 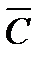
Q = 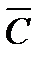
Приравняв правые части равенств и получим
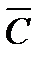
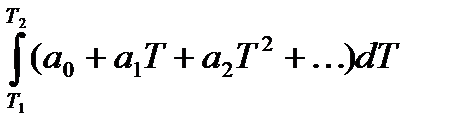

При интегрировании с учетом степенного ряда получим
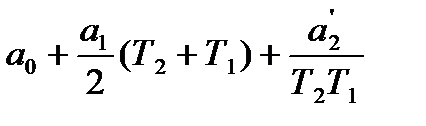
Для определения истиной теплоемкости по средней в пределах от 0 до Т необходимо умножить среднюю теплоемкость на Т и продифференцировать по Т:
Сист = (d/dT)( 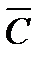
Если температура выражена в градусах Цельсия, то это уравнение записывают так:
Сист = (d/dT)( 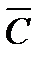
Теплоемкость газовых смесей суспензий, эмульсий, если между их составными частями не наблюдается химическое взаимодействие, является аддитивной величиной и для расчетов можно использовать формулу правила смешения
Ссмеси =
Ссмеси = 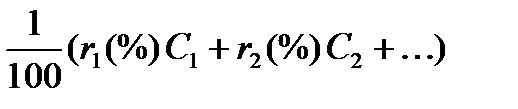
где т1(%)т2 (%), … — содержание компонентов в смеси в масс. долях (%); с1, с2, … — массовые теплоемкости соответствующих веществ; r1(%), r2(%), … — молярные (а для газов то же, что и объемные) доли (%) составных частей смеси; С1, С2, … — молярные теплоемкости. Влияние температуры на теплоемкость жидкостей и твердых веществ сказывается в меньшей степени, чем для газов (наблюдается незначительный рост теплоемкости жидкостей с повышением температуры). Теплоемкость твердых веществ при высоких температурах почти не изменяется. При низких температурах теплоемкость твердых веществ меняется очень сильно, приближаясь к нулю при температурах, близких к абсолютному нулю. Теплоемкость твердых веществ можно вычислять по эмпирической формуле, согласно которой теплоемкость твердых химических соединений равна алгебраической сумме теплоемкостей элементов, входящих в данное соединение:
где Свещ — теплоемкость твердого вещества; n – доля элемента, входящего в данное вещество; Ci – теплоемкость данного элемента в соединении. Формула пригодна для подсчета теплоемкостей сплавов. Теплоемкость растворов с повышением их концентрации в большинстве случаев падает и не подчиняется строго правилу аддитивности. Однако достаточно точно теплоемкость растворов в пределах концентраций до 40 – 50% можно определять по правилу смешения (аналогично газовым смесям). При растворении кислот и щелочей в воде наблюдаются глубокие физико-химические изменения и расчет теплоемкостей по правилу смешения допустим только при небольших концентрациях. Для определения теплоемкостей растворов кислот, щелочей и солей при различных концентрациях пользуются графиками в координатах теплоемкость – концентрация раствора, построенными по опытным данным.
Пример 1.Определить теплоту, которую отдадут 100 кг паров метилового спирта при охлаждении от 200 до 100º С при нормальном давлении.
Р е ш е н и е. Количество выделяемой теплоты можно рассчитать двумя способами: 1) использовать значение средней (массовой) теплоемкости между 200 и 100º С (с учетом массы паров спирта); 2) определив среднюю массовую теплоемкость паров метилового спирта от 0 до 200 и от 0 до 100º С. Подсчитав относительные количества теплоты при t1 = 200ºC и при t2 = 100º С (с учетом массы паров), вычитают одно из другого. Воспользуемся вариантом 2. Из таблицы находим для СН3ОН среднее молярные теплоемкости при нормальном давление: 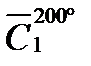
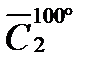
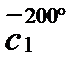


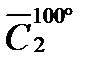
Q = 100 ( 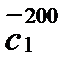
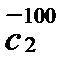
Пример 2.Определить теплоту, поглощающую при нагревании 100 г диоксида углерода от 15 до 100º С при постоянное объеме, если

Р е ш е н и е. Температуру можно взять в градусах Цельсия:
Q = 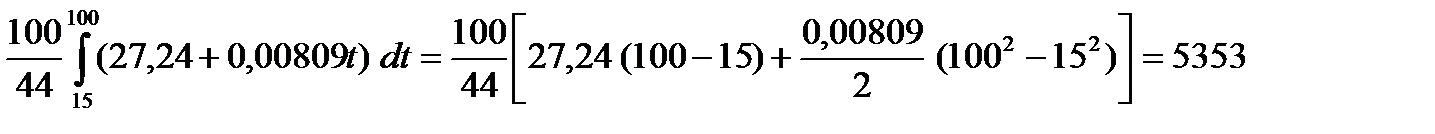
Пример 3.Рассчитать среднюю молярную теплоемкость водорода в интервале 400 — 500º С, если
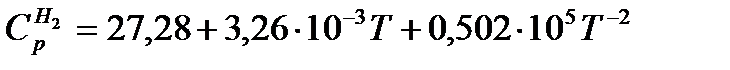
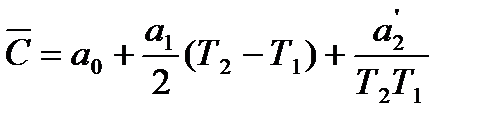
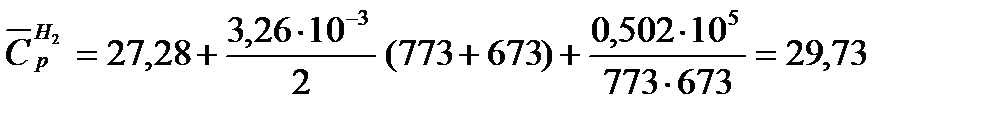
Пример 4.Вычислить массовую теплоемкость сплава состава (масс. доля, %): Bi 50,7; Pb 25,0; Cd 10,1; Sn 14,2 , если 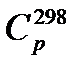
Р е ш е н и е. Вычисляем массовую теплоемкость:
ср = 0,507 ∙ 0,122 + 0,25 ∙ 0,129 + 0,101 ∙ 0,231 + 0,142 ∙ 0,221 = 0,148 кДж / (кг ∙ К).
31. Средняя массовая теплоемкость паров бензола в пределах температур 85 — 115º С (при нормальном атмосферном давлении) равна 1,257 кДж/(кг ∙ К). вычислить среднее молярные теплоемкости бензола при постоянных давлении и объеме и их соотношение 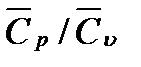
32. Средняя массовая теплоемкость при постоянном (нормальном) давлении для водяного пара в пределах температур 100 — 500º С равна 2,01 кДж/(кг ∙ К). вычислить средние молярные теплоемкости водяного пара при постоянных давлении и объеме и их соотношение 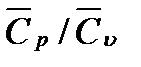
33. Температурная зависимость истинной молярной теплоемкости воздуха выражается уравнением
Вычислить: а) истинную молярную и массовую теплоемкости воздуха при постоянных давлении и объеме при 400º С, если соотношение 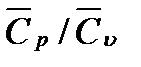
34. Молярная теплоемкость азота при н. у. равна 20,95 кДж / (кмоль ∙К). определить массовую и объемную теплоемкости азота при тех же условиях.
35. Зависимость молярной теплоемкости паров ацетона от температуры выражается уравнением
Ср= 31,59 + 154,94 ∙ 10 -3 Т – 30,38 ∙ 10 -6 Т 2 .
Вычислить расход теплоты (Дж) на нагревание 116,2 г ацетона от 298 до 500 К.
36. Вычислить количество поглощенной теплоты (кДж) при нагревании 1 кг этилового спирта от 127 до 327º С (при постоянном давлении) , если температурная зависимость истиной молярной теплоемкости [кДж/(кмоль ∙ К)] выражается формулой
37. Вычислить количество выделившейся теплоты при изобарного охлаждении 100 кг формальдегида от 500 до 200º С, если температурная зависимость молярной теплоемкости[кДж/(кмоль ∙ К)]выражается уравнением
38. Какое количество теплоты потребуется для нагревания 10 кг паров изопрена от 127 до 227º С при нормальном давлении если температурная зависимость истиной молярной теплоемкости [кДж/(кмоль ∙ К)] выражается формулой
39. Определить массовую теплоемкость железной руды состава (об. доли, %);Fe2O3 84,1; H2O 7,5; SiO2и пустая порода 8,4. Массовые теплоемкости [кДж/(кг ∙ К)] компонентов руды соответственно равны 0,610; 4,2; 1,17
40. Рассчитать массовую теплоемкость сплава, состоящего из 80% меди и 20% олова при 25º С. Средняя массовая теплоемкость меди в интервале 20 — 100º С равна 0,394 кДж/(кг ∙ К), а олова в интервале 19 — 99º С 0,231 кДж/(кг ∙ К). сравнить полученный результат с табличным: С = 0,3606кДж/(кг ∙ К).
Термохимия. Закон Гесса
Тепловым эффектом химической реакции называется теплота, выделения или поглощения в процессе, протекающем необратимо при постоянстве объема или давления (продукты реакции при этом имеют ту же температуру, что и исходные вещества). В термохимии (в отличие от термодинамики) выделяемая системой теплота считается положительной, а поглощаемая – отрицательной. Теплоту в термодинамическом понимании обозначают 

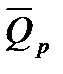

т.е. изохорный тепловой эффект химической реакции равен убыли внутренней энергии реагирующей системы. Изобарный тепловой эффект равен убыли энтальпии реагирующих веществ:
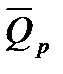
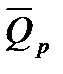

Формула позволяет по величине 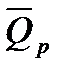

В термодинамических расчетах широко используют следующие два следствия закона Гесса:
1.Тепловой эффект химической реакции равен разности между суммой теплот образования продуктов( 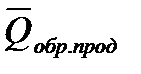
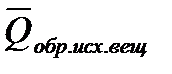
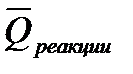
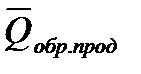
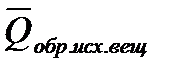
2. Тепловой эффект химической реакции равен разности между суммой теплот сгорания исходных веществ ( 

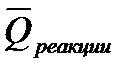
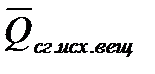

Закон Гесса и следствия (1,2) позволяют вычислять тепловые эффекты различных реакций на основе сравнительно небольшого количества табличных данных о теплотах образования неограниченных веществ и теплотах сгорания органических соединений при стандартных условиях (р = 101 325 Па, t = 25ºCили 298 К). Поскольку расчеты в химии и химической технологии чаще всего приходится производить для изобарных процессов, то можно использовать табличные значения 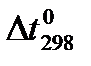

Для простых веществ условно 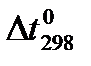
В основе расчетов тепловых эффектов по энергиям связей атомов, входящих в состав данного химического соединения, лежат следующие положения:
1) каждая определенная связь между атомами имеет более или менее постоянную энергию независимо от того, в какое химическое соединение эти атомы входят;
2) атомные связи обладают свойством аддитивности, т. е. энергия образования молекулы из свободных атомов в газообразном состоянии приблизительно равна сумме энергий связей отдельных ее частиц. Теплоты образования, вычисления по энергиям связи атомов в молекуле, в ряде случаев не совпадают с действительными данными, так как не всегда соблюдается аддитивность свойств энергии связей. Тепловое растворение ( 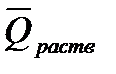
По интегральной теплотой растворения понимают теплоту растворения 1 моль вещества в большом количестве растворителя (число молей растворителя п→∞). при измерении 

где т – масса раствора, т = G + g; М – молекулярная масса растворяемого вещества; ср искал– теплоемкости раствора и калориметра. Для вычисления теплоты растворения 1 моль минеральной кислоты в п моль воды пользуются эмпирическими формулами:

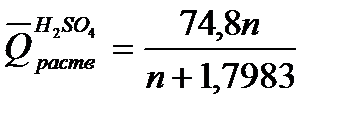
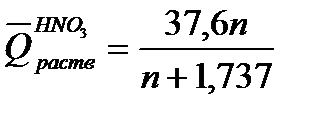
Теплотой сгорания называется теплота (кДж), выделяющаяся при полном сгорании 1 моль вещества в токе кислорода. Теплоты сгорания веществ определяют калориметрически или приближенно рассчитывают по формуле Д. П. Коновалова:
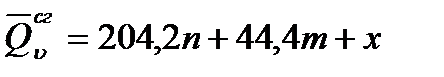
где п – число атомов кислорода, необходимых для полного сгорания одного моля данного вещества (по уравнению реакции); т – число молей воды, образующихся при сгорании (по уравнению реакции); х – термическая характеристика – величина постоянная для всех членов одного гомологического ряда. Чем больше в соединении непредельных связей, тем больше х. Если в молекулу входят различные группы и типы связей, то термическую характеристику определяют суммированием (∑х).
Пример 1.Определить теплоту сгорания этилена
С2Н4 + 3О2 = 2СО2 + 2Н2О(ж) +
исходя из следующих данных:
Р е ш е н и е. В данном случае можно воспользоваться двумя методами.
1-й метод.Комбинируя заданные термохимические уравнения, исключаем водород и углерод, которые не участвуют в реакции горения этилена.
Сгр + О2 = СО2 + 787,8
Полученный результат складываем почленно, предварительно умножив его на 2:
2-й метод. Применяем 1-е следствие Гесса, поскольку все приведенные в условии задачи тепловые эффекты являются теплотами образования соответственно этилена, диоксида углерода и жидкой воды из простых веществ: графита, водорода и кислорода:
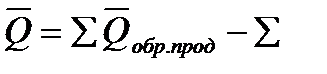

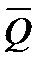
Пример 2.Рассчитать тепловой эффект сгорания диэтилового эфира (С2Н5)2О по энергиям разрыва связей при 298 К. Теплота испарения эфира 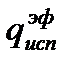
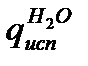
Р е ш е н и е. Реакция горения диэтилового эфира протекает по уравнению
Н—С—С—О—С—С—Н(ж) + 6О2 = СО2 + 5Н2О(ж) +
Тепловой эффект реакции равен разности теплот испарения и энергий разрыва связей продуктов реакции и исходных веществ. В молекуле эфира имеются связи: 10 С – Н, 2 С — С и 2 С – О. Находим энергии отдельных связей и вычисляем 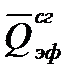
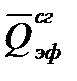
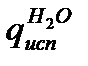
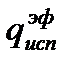
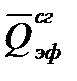
Пример 3.Какое количество теплоты выделится при растворении 200 г моногидрата Н2SO4 в 350 см 3 воды?
Р е ш е н и е. Для вычисления 
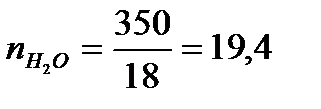
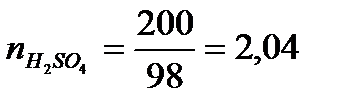
На 1 моль Н2SO4приходится 19,4 : 2,04 = 9,50 моль Н2О

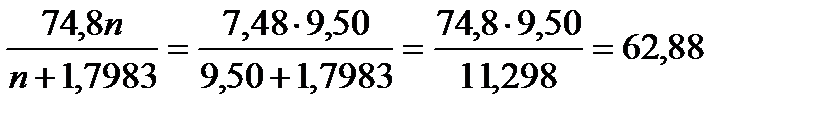
При растворении 200 г Н2SO4в 350 м 3 воды выделится теплоты
q = 62,88 ∙ 2,04 = 128,28кДж.
Пример 4.Вычислить теплоту сгорания газообразного гексана 
Р е ш е н и е. Горение гексана в калориметрической бомбе протекает постоянном объеме по уравнению
Для предельных углеводородов х = 0. При горении горении гексана п = 19, а т= 7. Тогда
Значение 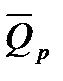
При подсчете ∆п учитываем только газообразные вещества:
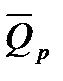
Табличная величина 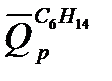
41. Определить теплоту сгорания спирта
С2Н5ОН + 3О2 = 2СО2 + 3Н2О(ж) +
исходя из следующих данных:
Н2 + 
2С + 3Н2 + 
42. Вычислить теплоту образования бензола
6С + 3Н2 = С6Н6 +
если теплоты сгорания водорода, углерода и бензола соответственно равны (кДж/моль) 285,0; 394,0; 3282,4 (вода образуется в жидкой состоянии).
43. Определить количество теплоты, выделяющейся при гашении 500 кг извести водой, если
Са + 
Н2 + 
44. Определить, какое количество теплоты потребуется для образования 100 г уксусноэтилового эфира по уравнению реакции
С2Н5ОН + СН3СООН → СН3СООС2Н5 + Н2О
если теплоты сгорания этилового спирта, уксусной кислоты и уксусноэтилового эфира соответственно равны 1374; 871,6 и 2256 кДж/моль.
45. Какое количество теплоты выделится при растворении 50 г моногидрата серной кислоты в 100 см 3 воды?
46. Какое количество теплоты выделится при растворении 200 г 38%-ной соляной кислоты в 400 см 3 воды?
47. Какое количество теплоты выделится при растворении 100 г 67%-ной азотной кислоты в 150 см 3 воды?
48. Вычислить по формуле Д. П. Коновалова теплоту сгорания жидкого этилового спирта и сравнить с табличным значением 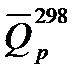
49. Вычислить по формуле Д. П. Коноваловатеплоту сгорания 
С6Н5—СН=СН—С + 21,2О2 = 9СО2 + 4Н2О +
и сравнить полученную величину с табличной — 4729кДж/моль.
Зависимость теплоемкости от температуры
По этой ссылке вы найдёте полный курс лекций по математике:
В практике тепловых расчетов широкое применение получила следующая приближенная зависимость истинной удельной теплоемкости от температуры: где а — экспериментальное значение истинной теплоемкости при температуре О °С; b> d> е — постоянные коэффициенты, зависящие от природы рабочего тела, определяемые на основании экспериментальных данных.
Для менее точных расчетов зависимости истинной удельной теплоемкости от температуры применяется уравнение второй степени: Для двухатомных газов часто ограничиваются первыми двумя членами уравнения (3.13): В табл. 3.1 приведены температурные зависимости истинных мольных теплоемкостей при постоянном давлении для некоторых газов. Зная зависимость с = /(f), можно аналитически определить теплоту или удельную теплоту, исходя из определений «»Я?. Q = JCdt, g-Jcdt. Таблица 3.1 Газ „ х кДж
Мольная теплоемкость С„, ——=т Р кмоль•К Азот 28,97 + 0,002566* Водород 28,78 + 0,001117* Кислород 29,56 + 0,003404* Окись углерода 29,06 + 0,002818* Воздух 29,09 + 0,002412* Водяной пар 32,85 + 0,00544* Углекислота 36,05 + 0,0203* — 0,00000642*2 Однако в практических расчетах используется более простой способ, при котором удельная теплота определяется через среднюю удельную теплоемкость процесса ст: В справочной литературе в основном приводятся коэффициенты для истинной удельной или мольной теплоемкости.
Зная их, можно самостоятельно получить выражение для средних теплоемкостей.
Зависимость истинной удельной теплоемкости от абсолютной температуры с = f(T) можно получить на примере формулы (3.15). Так как t = Т — 273,15, то с = а + b • (Т — 273,15). Обозначив через а’ — а — Ь* 273,15, получим с = а’ + ЬТ. Тогда в процессе нагрева от Тх до Т2 количество сообщенной ТРТ удельной теплоты может быть подсчитано по уравнению д=[а’+|(Г2 + Т1)](Т2-Т1), а средняя удельная теплоемкость запишется в виде Ряд экспериментальных исследований показал, что с понижением температуры теплоемкость водорода быстро уменьшается и уже при Т = 60 К его мольная теплоемкость становится равной теплоемкости идеального одноатомного газа.
| Явление падения теплоемкости с понижением |
температуры находится в полном соответствии с положениями молекулярно-кинети-ческой теории теплоемкости. При низких абсолютных температурах прекращаются и вращательные движения молекул, и колебательные движения атомов внутри молекул, а остаются лишь три степени свободы поступательного движения, свойственные молекуле идеального одноатомного газа.
Результатом этого и является приближение теплоемкости всех газов при низких температурах к значению теплоемкости идеального одноатомного газа. В 1906 г. Нернст высказал предположение о том, что при последующем понижении температуры и приближении ее к абсолютному нулю должно прекратиться и поступательное движение молекул и тогда любой газ приобретает свойства твердых тел. Проводя опыты над рядом твердых тел вблизи абсолютного нуля, Нернст показал, что теплоемкости твердых тел стремятся к нулю при Т 0 К, а для всех твердых тел при температуре Т — 0 К теплоемкости равны нулю.
Возможно вам будут полезны данные страницы:
Иными словами, при Т = 0 К частицы вещества (молекулы) превращаются в жесткую систему, лишенную тепловых движений. Из этого следует, что эмпирическая зависимость теплоемкости от температуры в виде уравнения (3.18) является справедливой только в области высоких температур и совершенно недействительна в области низких абсолютных температур. Истинный характер изменения теплоемкости от температуры показан на рис. 3.2.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://lektsia.com/2x34f7.html
http://natalibrilenova.ru/zavisimost-teploemkosti-ot-temperaturyi/