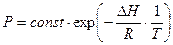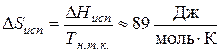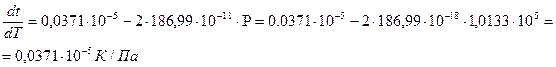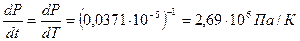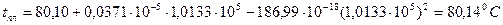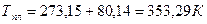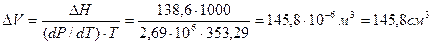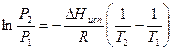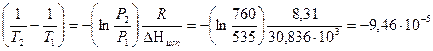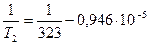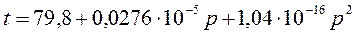Равновесие между конденсированными и газообразными фазами
Это равновесие типа кристаллы 


Приведем уравнение 2.1 к виду более удобному для практического применения. Используем два приближения:
1. При температурах, далеких от критической, Vпар>>Vж; Vпар>>Vтв.; ΔV ≈ Vпар.
2. Вдали от критической температуры насыщенный пар подчиняется уравнению состояния идеальных газов
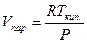
Тогда уравнение (2.1) преобразуется следующим образом:
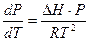
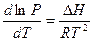
Интегрирование этого уравнения при 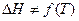
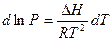
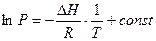
Рисунок 2.2 – зависимость давления насыщенного пара от температуры в координатах (ln P;1/Т)

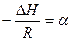
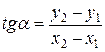
Точки (не обязательно экспериментальные) выбирать отстоящими подальше друг от друга.
Коэффициент «b» из графика найти невозможно, если в начале координат не 0. Поэтому найти «b» можно из уравнения для какой-либо точки, лежащей на прямой. Определив «а», найти теплоту испарения:
где R=8,31 Дж/моль·К.
Интегрирование уравнения в определенных пределах приводит к уравнению:
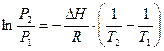
по которому можно рассчитать теплоту испарения по двум экспериментальным значениям давлений и температур.
Согласно эмпирическому правилу Трутона молярная энтропия испарения при нормальной температуре кипения для многих жидкостей постоянна и равна:
где Тн.т.к. – нормальная температура кипения при Р = 1 атм.
Для полярных жидкостей с сильными межмолекулярными взаимодействиями ΔSисп. превышает данную величину. Например, для воды она равна 109 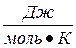
2.3 Примеры решения задач.
Задача 1
Зависимость температуры плавления нафталина от давления выражается уравнением: tпл = 80,10 + 0,0371×10 -5 P(Па) – 186,99×10 -18 Р 2 (Па).
Рассчитать изменение объема при плавлении 1 кг нафталина при Р = 1 атм, если его теплота плавления равна 138,6 Дж/кг.
Р = 1 атм = 1,0133×10 5 Па
Для фазовых переходов конденсированных фаз применяется уравнение: 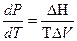
Определим сначала производную 
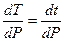
Откуда
Задача 2
Давление пара хлороформа при 50 0 С равно 535 мм. рт. ст., теплота испарения хлороформа 30,836 кДж/моль. Определить нормальную температуру кипения хлороформа.
T1=50 0 C = 323 К
Р2 = 1 атм. = 760 мм.рт.ст.
DНисп. = 30,836 кДж/моль
Нормальная температура кипения (н.т.к.) – температура кипения при Р = 1 атм.
Для решения используется уравнение для фазового перехода с участием газов:
Примечание. В данной задаче теплота испарения в данном температурном интервале принята постоянной, поэтому было использовано уравнение для DН = соnst.
Если же DНисп. = f (Т), то надо использовать дифференциальное уравнение для нахождения DНисп или DНвозг. Поскольку зависимости lnP=f(T) и lnKP=f(T) аналогичны, предлагаем обратиться к решению задачи № 3 на странице 42.
2.4 Двухкомпонентные системы
Дата добавления: 2016-06-22 ; просмотров: 2771 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Примеры решения типовых задач. DHисп = lисп×МHg = 283,2 Дж/г ×200,6 г/моль =
1. Температура кипения ртути при нормальном атмосферном давлении равна 357°С. Теплота испарения равна 283,2 Дж/г. Определить изменение давления пара ртути при изменении температуры на 1°С вблизи температуры кипения ртути при нормальном атмосферном давлении.
Т = 357 + 273 = 630 К
2. Давление паров воды при 97°С равно 90919,9 Па, а при 103°С – 112651,8 Па. Определить давление паров воды при 110°С.
3. Удельная теплота плавления нафталина при tпл = 79,9 о С равна 149,25 Дж/г. Разность удельных объемов в жидком и твердом состояниях (DV) при 79,9°С равна 0,146 см 3 /г. Определить изменение Тпл нафталина при увеличении давления в 100 раз по сравнению с атмосферным.

Так как давление дано в Па, а DHпл в Дж/г то DV должно быть выражено в м 3 /кг, а энтальпия плавления в Дж/кг.

DТпл = 3,452×10 –7 ×(101,3×10 2 ×10 3 – 101,3×10 3 ) = 3,46 К.
Задачи для самостоятельного решения
1. Энтальпия испарения воды при температуре кипения при нормальном атмосферном давлении равна 2258,4 Дж/г. Определить изменение давления пара воды при изменении температуры на 1°С вблизи температуры кипения.
2. Температура кипения ртути при нормальном атмосферном давлении равна 357°С. Изменение давления пара ртути при изменении температуры на 1°С вблизи температуры кипения при нормальном атмосферном давлении равно 1,744×10 3 Па. Вычислить энтальпию испарения ртути в Дж/г.
3. Давление паров воды при 95° и 97°С соответственно равно 84513 и 90920 Па. Вычислить энтальпию испарения воды (Дж/моль) и количество теплоты, необходимое для испарения 100 кг воды.
(Ответ: 41,36 кДж/моль; 229,8 МДж)
4. Давление паров иода при 90°С равно 3572,4 Па, а при 100°С – 6065,15 Па. Определить давление паров иода при температуре 115 о С.
5. Температура плавления (°С) нафталина в зависимости от давления (Па) выражается уравнением
Разность удельных объемов в жидком и твердом состоянии равна 0,146×10 –3 м 3 /кг. Рассчитать энтальпию плавления при давлении 50,66×10 5 Па.
6. Зависимость давления p пара никотина C10H14N2 от температуры t имеет вид (1 атм =760 мм рт. ст.)
| t, °С |
| p, мм рт. ст. |
По графику зависимости lnp от 1/T рассчитайте энтальпию испарения в указанном интервале температур.
(Ответ: 41,29 Дж/моль)
Фазовые равновесия в двухкомпонентных системах, перегонка
Основные уравнения
Если система состоит из двух компонентов, а на состояние равновесия влияют такие внешние факторы, как температура и давление, то правило фаз Гиббса имеет вид:
| С = 2 – Ф + 2 = 4 – Ф. | (145) |
При Сmin = 0 число фаз Ф = 4. Следовательно, в двухкомпонентной системе число фаз, одновременно находящихся в равновесии, не может быть больше четырех (ж, п, Ат, Вт). Максимальное число степеней свободы Сmax при Фmin = 1 равно 3 (давление, температура и концентрации х1 одного из компонентов). При выражении концентрации в процентах или долях x1 = 1 – х2 и при выбранных параметрах (р, Т, х1 = 1 – х2) состояние двухкомпонентной системы можно изобразить с помощью трехмерной диаграммы. Часто состояние двухкомпонентных систем изучают при p = const или T = const. В этом случае уравнение (145) приобретает вид
| С = 2 – Ф + 1 = 3 – Ф, | (146) |
а диаграмма, построенная в координатах «температура – состав» или «давление – состав», будет плоской.
Равновесие «твердое вещество – жидкость».
Фазовая диаграмма системы с простой эвтектикой
Равновесия в системах «твердое вещество – жидкость» встречаются при изучении различных металлических сплавов, силикатов, водных растворов солей, систем, состоящих из органических соединений.
Особое значение имеют исследования зависимостей температур начала и конца кристаллизации твердых веществ от состава системы. Графики, выражающие эту зависимость, называются фазовыми диаграммамиили диаграммами плавкости.
Диаграммы плавкости строятся на основании результатов термического анализа, который заключается в наблюдении за скоростью охлаждения расплавленных чистых веществ и их смесей.
Диаграммы такого типа отвечают бинарным системам, в которых вещества неограниченно смешиваются в жидком состоянии, образуя гомогенный раствор и практически не растворяются в твердом состоянии, образуя гетерогенную систему из твердых фаз.
Рассмотрим построение и анализ такой диаграммы на примере системы из веществ А и В.
|
Рис. 41. Фазовая диаграмма системы
с простой эвтектикой
Линия 
· область I –жидкий расплав;
· область II – гетерогенная система, состоящая из кристаллов вещества А и жидкого расплава переменного состава;
· область III – гетерогенная система, состоящая из кристаллов вещества В и жидкого расплава переменного состава;
· область IV – гетерогенная система, состоящая из смеси кристаллов А и В.
Каждая точка на диаграмме называется фигуративной и соответствует одному строго определенному состоянию системы в зависимости от того, где эта точка лежит.
Чтобы найти состав сосуществующих фаз, надо через фигуративную точку провести горизонталь до пересечения с граничными линиями, из точки пересечения с одной граничной линией опустить перпендикуляр на ось состава – это даст состав одной фазы, из другой – состав другой фазы. Например, для того чтобы найти состав сосуществующих фаз в точке r, проведем горизонталь до пересечения с линией ликвидус и опустим перпендикуляр из точки пересечения (S), определим массовую долю В в расплаве (ωВ), второй конец горизонтали пересекается с левой осью ординат, соответствующей чистому веществу А, находящемуся при температуре tr, ниже температуры его плавления (t 0 А), следовательно вещество А находится в виде кристаллов.
Диаграмма плавкости позволяет определить не только число фаз и их состав, но и относительные массы фаз, с помощью правила рычага:
 , , | (147) |
где gж – масса расплава, г; gтв – масса кристаллов, г.
Отрезки trr и rS измеряются на диаграмме в сантиметрах или миллиметрах (рис. 41).
Одним из методов построения диаграмм состояния является метод термического анализа, который заключается в построении кривых охлаждения. Рассмотрим пример: расплавим чистое вещество А и будем его равномерно охлаждать, измеряя температуру. Нанеся эти данные на график, получим кривую охлаждения(рис. 42). Кривая охлаждения любого чистого вещества (однокомпонентная система K = 1) будет состоять из трех участков ab, bc, cd.
Рис. 42. Кривая охлаждения чистого вещества
Изломы на кривых охлаждения (графиках в координатах «температура – время») свидетельствуют об изменении числа фаз в системе (рис. 42 и 43).
Участок ab соответствует охлаждению чистого жидкого вещества А, так как охлаждение ведется равномерно, то он соответствует прямой линии, наклоненной под определенным углом. Число степеней свободы (С) в такой системе рассчитываем по правилу фаз Гиббса: С = K – Ф + n; n = 1, а С = 1 – 1 + 1 = 1 (то есть температура понижается, но при этом сохраняется жидкая фаза).
Когда в жидкости появятся первые кристаллы, система станет двухфазной (твердая и жидкая фазы), а число степеней свободы становится равным нулю: С = 1 – 2 + 1 = 0. Следовательно, при охлаждении однокомпонентной системы (чистого вещества) температура не может изменяться, на кривой охлаждения появляется горизонтальный участок – участок bc.
Охлаждение системы компенсируется теплотой, которая выделяется при кристаллизации. Таким образом, температура горизонтального участка – это температура кристаллизации чистого вещества А.
Когда вся жидкость закристаллизуется, в системе останется одна фаза – твердая, число степеней свободы снова станет равно 1: С = 1 – 1 + 1 = 1.
Такая же кривая охлаждения соответствует и чистому веществу В, только горизонтальный участок будет наблюдаться при другой температуре (при температуре плавления В).
Теперь к твердому веществу А добавим 10% вещества В, смесь расплавим, получим расплав и будем его охлаждать. По результатам охлаждения построим кривую охлаждения (рис. 43), она состоит из четырех участков: mn, nf, fk и kl.
Рис. 43. Кривая охлаждения смеси
Участок mn соответствует охлаждению расплава:
Как только в расплаве появятся кристаллы вещества А (С = 2 – 2 + 1 = 1), температура системы будет понижаться уже медленнее из-за того, что при образовании кристаллов выделяется теплота, замедляющая охлаждение, на кривой появится изгиб (точка n), который будет указывать температуру начала кристаллизации (Tn). В соответствии с законом Рауля наблюдается понижение температуры замерзания раствора (температура начала выпадения кристаллов) по сравнению с температурой замерзания чистого жидкого вещества, поэтому Tn
Зависимость температуры плавления нафталина от давления выражается уравнением
6. Фазовое равновесие в однокомпонентных системах
Условием равновесия между двумя фазами является равенство давления, температуры и химических потенциалов (мольных энергий Гиббса) в обеих фазах. Если температура изменяется при постоянном давлении или давление изменяется при постоянной температуре, то равновесие нарушается и одна из фаз исчезает. Изменение химических потенциалов фаз при этом можно рассчитать по уравнениям:
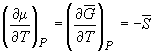
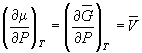
где 
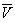
Условие сосуществования двух фаз при одновременном изменении давления P и температуры T описывается уравнением Клапейрона:
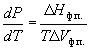
где Hф.п. – мольная энтальпия равновесного фазового перехода (плавление, испарение, возгонка, переход между модификациями), Vф.п. – разность мольных объемов фаз, находящихся в равновесии.
В случаях испарения и возгонки уравнение (6.3) можно упростить, считая, что мольным объемом конденсированной фазы (жидкости или твердого тела) Vк.ф. по сравнению с мольным объемом пара Vпар можно пренебречь и что пар подчиняется уравнению состояния идеального газа. Подставляя (Vпар – Vк.ф.) Vпар и Vпар = RT/P, получаем уравнение Клаузиуса-Клапейрона:
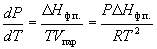
или после преобразования
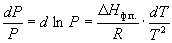
Интегрирование в предположении, что Hф.п. не зависит от температуры (что справедливо в узких интервалах температур), дает
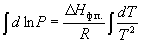
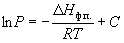
где C – константа интегрирования. Следовательно, зависимость lnP от 1/Т должна быть линейной, а наклон прямой равен – Hф.п./R.
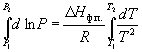
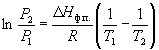
По этому уравнению можно рассчитать энтальпию испарения или возгонки, исходя из значений давления пара при двух разных температурах.
Мольные энтальпии возгонки, плавления и испарения при данной температуре связаны соотношением
возгH = плH + испH (6.10)
Энтальпию испарения жидкости можно приближенно оценить по правилу Трутона, согласно которому мольная энтропия испарения в нормальной точке кипения (при 1 атм) приблизительно постоянна:
испS = 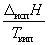
Правило хорошо выполняется для неполярных жидкостей.
Зависимость энтальпии фазового перехода от температуры можно рассчитать по закону Кирхгофа:
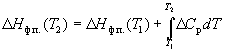
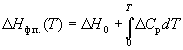
где Cp – разность теплоемкостей фаз, находящихся в равновесии, H0 – константа интегрирования, определяемая из известных значений Hф.п. и Cp. Для небольших интервалов температуры можно считать, что Cp = const. В этом случае из уравнения (6.13) получаем:
Hф.п. (T) = H0 + T Cp. (6.14)
Подставляя уравнение (6.14) в уравнение (6.7), получаем:
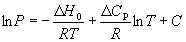
в котором С определяют из известных значений P, H0 и Cp.
Пример 6-1. Рассчитать изменение давления, необходимое для изменения температуры плавления льда на 1 o C. При 0 o C энтальпия плавления льда равна 333.5 Дж . г –1 , удельные объемы жидкой воды и льда равны Vж. = 1.0002 см 3 . г –1 и Vтв. = 1.0908 см 3 . г –1 .
Решение. Изменение объема при плавлении льда равно
Vж. – Vтв. = 1.0002 – 1.0908 = –0.0906 см 3 . г –1 = –9.06 10 –8 м 3 . г –1 .
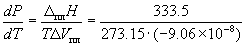
Таким образом, при повышении давления на 133 атм температура плавления льда понижается на 1 градус. Знак «минус» показывает, что при повышении давления температура плавления понижается.
Ответ. P = 133 атм.
Пример 6-2. Рассчитать давление пара жидкого брома при 25 o C. fG o газообразного брома равна 3.110 кДж . моль –1 .
Решение. испG o брома равно fG o [Br2 (г)] = 3110 Дж . моль –1 .
испG o = 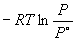
Ответ. P = 0.2852 атм.
Пример 6-3. Рассчитать давление, при котором графит и алмаз находятся в равновесии при 25 o C. fG o алмаза равна 2.900 кДж . моль –1 . Считать плотности графита и алмаза равными 2.25 и 3.51 г . см –3 соответственно и не зависящими от давления.
Решение. Изменение объема при переходе от графита к алмазу равно
V = 12 . 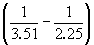
При начальном давлении P1 разность мольных энергий Гиббса G1 = 2900 Дж . моль –1 , а при конечном давлении P2 разность G2 =0.
Поскольку 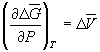
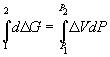
Отсюда P2 = 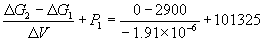
Ответ. P = 1.5 10 4 атм.
Пример 6-4. Температура кипения бензола при давлении 1 атм равна 80.1 o C. Оценить давление пара бензола при 25 o C.
Решение. Давление пара бензола при T1 = 353.3 K равно P1 = 1 атм. По правилу Трутона испH = 88 . 353.3 = 31.1 кДж . моль –1 . Подставим эти данные в уравнение (6.9). Получим:
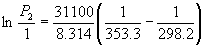
ЗАДАЧИ
- Рассчитать давление, при котором две формы CaCO3 – кальцит и арагонит – находятся в равновесии при 25 o C. fG o кальцита и арагонита при 25 o C равны –1128.79 и –1127.75 кДж . моль –1 соответственно. Считать, что плотности кальцита и арагонита равны 2.71 и 2.93 г . см –3 соответственно и не зависят от давления.
- Рассчитать температуру, при которой две формы CaCO3 – кальцит и арагонит – находятся в равновесии при давлении 1 атм. При 25 o C fG o кальцита и арагонита равны –1128.79 и –1127.75 кДж . моль –1 соответственно, fH o равны–1206.92 и –1207.13 кДж . моль –1 соответственно. Считать, что CP = 0.
- fG o жидкой и газообразной воды при 25 o C равны –237.129 и –228.572 кДж . моль –1 соответственно. Рассчитать давление пара воды при 25 o C.
- Плотности жидкого и твердого олова при температуре плавления (231.9 o C) равны 6.980 г . см –3 и 7.184 г . см –3 соответственно. Энтальпия плавления олова равна 1.690 ккал . моль –1 . Определить температуру плавления олова под давлением 500 атм. Молярная масса олова равна 118.7 г . моль –1 .
- При замерзании бензола (5.5 o C) его плотность изменяется от 0.879 г . см –3 до 0.891 г . см –3 . Энтальпия плавления равна 10.59 кДж . моль –1 . Определить температуру плавления бензола при давлении 1000 атм.
- Плотности жидкой и твердой ртути при температуре плавления
(–38.87 o C) равны 13.690 и 14.193 г . см –3 соответственно. Энтальпия плавления ртути равна 2.33 кал . г –1 . Определить температуру плавления ртути при давлении 3000 атм. - Температура кипения жидкого метанола равна 34.7 o C при давлении 200 мм рт. ст. и 49.9 o C при давлении 400 мм рт. ст. Найти температуру кипения метанола при нормальном давлении.
- Давление пара диэтилового эфира при 10 o C равно 286.8 мм рт. ст., а при 20 o C – 432.8 мм рт. ст. Определить мольную энтальпию испарения и нормальную температуру кипения эфира.
- Давление пара дихлорметана при 24.1 o C равно 400 Торр, а его энтальпия испарения равна 28.7 кДж . моль –1 . Рассчитать температуру, при которой давление пара будет равно 500 Торр.
- Давление пара твердого CO2 равно 133 Па при –134.3 o C и 2660 Па при –114.4 o C. Рассчитать энтальпию возгонки.
- Давление пара (Торр) жидкости в интервале температур 200 – 260 K описывается уравнением:
ln p = 16.255 – 2501.8 / T.
Рассчитать энтальпию испарения и нормальную точку кипения жидкости.
Давление пара (Торр) жидкого бензола C6H6 между 10 o C и 80 o C описывается уравнением:
lg p = 7.960 – 1780 / T.
Рассчитать энтальпию испарения и нормальную точку кипения бензола.
403
Определить молярную массу уксусной кислоты в паре, если известно, что «испH = 24.35 кДж . моль –1 .
Давление пара (в мм рт. ст.) твердого и жидкого SO2 выражается уравнениями
http://megalektsii.ru/s69521t1.html
http://www.chem.msu.su/rus/teaching/eremin1/2-6.html