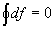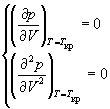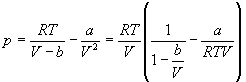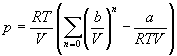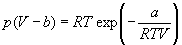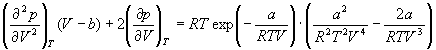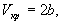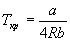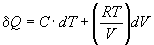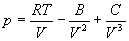Уравнения состояния и термодинамические процессы
Как правило, при взаимодействии какого-либо рода в системе одновременно изменяются значения нескольких параметров состояния. Однако опыт показывает, что среди параметров состояния всегда имеется один (и только один) такой параметр, изменение которого в равновесных процессах вызывается взаимодействием только одного определенного рода.
Параметры состояния, обязательно изменяющиеся при наличии взаимодействия данного рода и не изменяющиеся под влиянием взаимодействий иных родов, называются координатами термодинамического состояния. Если происходит изменение некоторой координаты состояния, то можно утверждать, что происходит обмен энергией в соответствующей форме.
Так, при деформационном взаимодействии необходимым и достаточным условием передачи энергии в форме работы является перемещение поршня, на который действует сила давления газа. Перемещение поршня приводит к изменению объема рабочего тела в цилиндре.
Следовательно, координатой деформационного состояния однородного рабочего тела является его объем.
Координатой термического состояния рабочего тела является энтропия. Изменение энтропии свидетельствует о том, что изменение состояния термодинамической системы происходит в результате передачи энергии в форме теплоты.
Как известно, изменение равновесного состояния термодинамической системы возможно только в результате внешних воздействий, а воздействие каждого рода приводит к изменению значения одной из координат состояния. Значит, для определения состояния системы достаточно знать значения всех координат состояния, которые полностью и однозначно определяют данное равновесное состояние. Значение остальных параметров состояния определяются по значениям координат состояния, то есть каждый параметр равновесного состояния системы является однозначной функцией всех координат состояния.
Уравнения, представляющие зависимость параметров (функций) состояния равновесной системы от координат состояния, называются уравнениями состояния термодинамической системы.
Если обозначить произвольную функцию состояния системы через j, а координаты состояния – через х1, х2, …, хn (n – число координат состояния, то есть термодинамических степеней свободы), то уравнение состояния можно представить в виде:
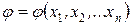
Например, состояние однородной термодеформационной системы описывается уравнениями, содержащими две независимые переменные: координату деформационного состояния – удельный объем u, координату термического состояния – удельную энтропию s. Остальные параметры (функции) состояния, например, температура и давление связаны со значениями координат соответствующими уравнениями состояния в виде:
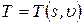
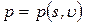
Температура и давление относятся к важной для термодинамического анализа группе величин, которая называется потенциалы термодинамических взаимодействий.
Потенциалом взаимодействия некоторого рода называется параметр состояния, различие значений которого между системой и окружающей средой на контрольной поверхности приводит к возникновению взаимодействия данного рода, то есть к передаче энергии в данной форме между системой и окружающей средой. Потенциалом для теплового взаимодействия является термодинамическая температура, а для деформационного механического взаимодействия – давление. Как правило, уравнения состояния содержат координаты и потенциалы термодинамической системы.
Представленные уравнения состояния для термодеформационной системы неудобны для практического применения, так как энтропия – неизмеряемая величина. Решая совместно эти уравнения, можно исключить энтропию, выразив ее через объем и температуру или через объем и давление. В результате получается термическое уравнение состояния, которое связывает давление, объем и температуру:
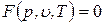
Уравнения состояния систем с двумя степенями свободы, являясь функциями с двумя независимыми переменными, позволяют построить некоторую поверхность, называемую термодинамической поверхностью или поверхностью состояния. Любое равновесное состояние системы изображается точкой, лежащей на этой поверхности. Если точка не лежит на поверхности состояния, то такое сочетание параметров состояния для данной системы невозможно.
Изменение состояния термодинамической системы в результате ее взаимодействия с окружающей средой называется термодинамическим процессом.
В результате осуществления термодинамического процесса происходит обмен энергией между системой и окружающей средой, который возможен лишь при наличии разности соответствующих потенциалов. А наличие разности потенциалов может привести к нарушению равновесия внутри термодинамической системы. Термодинамический процесс, протекающий с нарушением внутреннего равновесия в термодинамической системе, называется неравновесным.
Полное описание неравновесных процессов методами термодинамики невозможно вследствие неопределенности и чрезвычайно сложного характера изменений, происходящих при этом в системе. Поэтому для изучения принципиальных свойств систем при обмене энергией применяется идеализация реальных процессов и рассматриваются равновесные процессы.
Термодинамический процесс, протекающий с бесконечно малым отклонением состояния системы от равновесного состояния, называется равновесным.
При осуществлении равновесного процесса термодинамическая система проходит ряд бесконечно близких состояний, каждое из которых является равновесным. Каждое промежуточное состояние системы в процессе подчиняется уравнению состояния и изображается соответствующей точкой на термодинамической поверхности. Совокупность таких точек образует на поверхности состояний линию, которая называется линией термодинамического процесса.
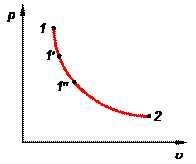 Рис. 1.2. Диаграмма состояния. Рис. 1.2. Диаграмма состояния. | В термодинамике широко используются графические методы анализа процессов. При этом удобнее использовать не пространственные трехмерные изображения линий процессов, а их двухмерные проекции на координатные плоскости. Координатные оси плоских диаграмм состояния соответствуют двум термодинамическим параметрам (рис. 1.2). Например, на р—u-диаграмме изображен какой-то равновесный процесс 1-2. Точки 1, 1¢, 1² и т.д. изображают равновесные состояния термодинамической системы. |
Тема: «ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ»(2 часа)
1. Первый закон термодинамики как закон сохранения и превращения энергии.
2. Свойства работы как формы обмена энергией.
3. Свойства теплоты как формы обмена энергией.
4. Уравнение первого закона термодинамики для закрытых систем
5. Уравнение первого закона термодинамики для открытых систем
Основная литература
1. Амерханов Р.А., Драганов Б.Х. Теплотехника. — М.: Энергоатомиздат, 2006. – 432 с.
Дополнительная литература
1. Теплотехника. /А.П. Баскаков, Б.В. Берг и др. – М.: Энергатомиздат, 1991. – 224 с.
2. Техническая термодинамика. / Кириллин В.А., Сычев В.В., Шейндлин А.Е. – М.: Издательский дом МЭИ, 2008. – 496 с.
Дата добавления: 2015-11-26 ; просмотров: 1580 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Вопрос 2. Параметры состояния и уравнения состояния.
Вопрос 2. Параметры состояния и уравнения состояния.
Параметры состояния — физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные (не зависят от массы системы) и экстенсивные (пропорциональны массе).
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы. Простейшие параметры:
1. 
2. 
3. 
4. 
Связь между параметрами, характеризующими состояние простого тела, называется уравнением состояния F (р, v, T) = 0.
Изменение состояния системы называется процессом.
Равновесный процесс — это непрерывная последовательность равновесных состояний системы.
Обратимый процесс — равновесный процесс, который допускает возможность возврата этой системы из конечного состояния в исходное путем обратного процесса.
Термодинамическим процессомпринято считать обратимый равновесный процесс.
Равновесные процессы могутбыть изображены графически на диаграммах состояния p-v, р-Т и т. д. Линия, изображающая изменение параметров в процессе, называется кривой процесса. Каждая точка кривой процесса характеризует равновесное состояние системы.
Уравнение термодинамического процесса – уравнение вида 
Уравнение состояния для простого тела — 
Идеальный газ – совокупность материальных точек (молекул или атомов), находящихся в хаотическом движении. Эти точки рассматриваются как абсолютно упругие тела, не имеющие объёма и не взаимодействующие друг с другом. Уравнением состояния идеального газа является уравнение Менделеева-Клапейрона:
PV=nRT, где P – давление, [Па]; V – объём системы [м 3 ]; n – количество вещества, [моль]; T – термодинамическая температура, [К]; R – универсальная газовая постоянная.
Реальный газ – газ, молекулы которого взаимодействуют друг с другом и занимают определённый объём. Уравнением состояния реального газа является обобщённое уравнение Менделеева-Клапейрона:

_____________________________________________________________
Вопрос 3. Термодинамическая работа, координаты P-V.
Термодинамическая работа: 


Удельная работа: 


— Если 

— Если 

— При малом изменении объёма давление практически не изменяется.


1. В случае если 

2. В случае если дано уравнение процесса — 




Вопрос 4. Потенциальная работа, координаты P-V, распределение работы.
Потенциальная работа – работа, вызываемая изменением давления.

— Если 

— Если 

— При малом изменении давления объём почти не меняется.


1. В случае если 

2. В случае если дано уравнение процесса — 



переданная внешним системам.

________________________________________________________
Вопрос 16. Изобарный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах P-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
Если 







Так как 

Для идеального газа:
Первое начало термодинамики: 
Для идеального газа: 







Вопрос 63. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
Дросселирование – процесс движения вещества через внезапное сужение. Причинами возникновения местных сопротивлений при движении потока рабочего тела по каналам могут быть запорные, регулирующие и измерительные устройства; повороты, сужение, загрязнение каналов и т.д.
Эффект Джоуля-Томсона — изменение температуры вещества при адиабатном дросселировании.
Рис. 1.7. Процесс дросселирования в h-s диаграмме
Различают дифференциальный и интегральный дроссель – эффекты. Величина дифференциального дроссель – эффекта определяется из соотношения


Интегральный дроссель-эффект: 
Коэффициент Джоуля – Томсона выводится из математических выражений первого начала термодинамики и второго начала термостатики
1. Если дроссель–эффект положительный (Dh > 0), то снижается температура рабочего тела (dT 0);
3. Если дроссель–эффект равен нулю (Dh = 0), то температура рабочего тела не изменяется. Состояние газа или жидкости, которому соответствует условие Dh = 0, называется точкой инверсий.
___________________________________________________________________
Двухтактный дизель
Рабочий процесс в двухтактном дизеле в основном протекает так же как и в двухтактном карбюраторном двигателе, и отличается только тем что продувка цилиндра производится чистым воздухом. По окончании ее оставшийся в цилиндре воздух сжимается. В конце сжатия через форсунку впрыскивается топливо в камеру сгорания и воспламеняется.Схема двухтактного дизеля с кривошипно-камерной продувкой показана на рисунке 14, а, а индикаторная диаграмма — на рисунке 14, 6.
Рабочий процесс в двухтактном дизеле протекает следующим образом.
Первый такт. При движении поршня вверх от н. м. т. к в. м. т. вначале происходит окончание продувки, а затем окончание выпуска. На индикаторной диаграмме продувка изображена линией b»— a» а выпуск — а» — а.
После закрытия выпускного окна поршнем в цилиндре происходит сжатие воздуха. Линия сжатия на индикаторной диаграмме изображена кривой а—с. В это время под поршнем в кривошипной камере создается разрежение, под действием которого автоматический клапан открывается, и в кривошипную камеру засасывается чистый воздух. В начале движения поршня вниз, вследствие уменьшения объема под поршнем, давление воздуха в кривошипной камере повышается, и клапан закрывается.
Второй такт. Поршень движется от в. м. т. к н. м. т. Впрыск и горение топлива начинаются перед концом сжатия и заканчиваются после того, как поршень пройдет в. м. т. По окончании горения происходит расширение. Протекание процесса расширения на индикаторной диаграмме изображено кривой r-b.
Остальные процессы, выпуск и продувка протекают так же, как и в карбюраторном двухтактном двигателе.
Вопрос 2. Параметры состояния и уравнения состояния.
Параметры состояния — физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные (не зависят от массы системы) и экстенсивные (пропорциональны массе).
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы. Простейшие параметры:
1. 
2. 
3. 
4. 
Связь между параметрами, характеризующими состояние простого тела, называется уравнением состояния F (р, v, T) = 0.
Изменение состояния системы называется процессом.
Равновесный процесс — это непрерывная последовательность равновесных состояний системы.
Обратимый процесс — равновесный процесс, который допускает возможность возврата этой системы из конечного состояния в исходное путем обратного процесса.
Термодинамическим процессомпринято считать обратимый равновесный процесс.
Равновесные процессы могутбыть изображены графически на диаграммах состояния p-v, р-Т и т. д. Линия, изображающая изменение параметров в процессе, называется кривой процесса. Каждая точка кривой процесса характеризует равновесное состояние системы.
Уравнение термодинамического процесса – уравнение вида 
Уравнение состояния для простого тела — 
Идеальный газ – совокупность материальных точек (молекул или атомов), находящихся в хаотическом движении. Эти точки рассматриваются как абсолютно упругие тела, не имеющие объёма и не взаимодействующие друг с другом. Уравнением состояния идеального газа является уравнение Менделеева-Клапейрона:
PV=nRT, где P – давление, [Па]; V – объём системы [м 3 ]; n – количество вещества, [моль]; T – термодинамическая температура, [К]; R – универсальная газовая постоянная.
Реальный газ – газ, молекулы которого взаимодействуют друг с другом и занимают определённый объём. Уравнением состояния реального газа является обобщённое уравнение Менделеева-Клапейрона:

_____________________________________________________________
Зависимость уравнения состояния от функций состояния
Глава 1. Основы химической термодинамики
1. Основные понятия термодинамики
Термодинамика — наука, изучающая взаимные переходы теплоты и работы в равновесных системах и при переходе к равновесию. Химическая термодинамика — раздел физической химии, в котором термодинамические методы применяются для анализа химических явлений: химических реакций, фазовых переходов и процессов в растворах.
Объект изучения термодинамики — термодинамические системы, т.е. макроскопические объекты, отделенные от окружающего пространства реальной или мысленной поверхностью. Системы бывают:
- открытые , в которых существует обмен энергией и веществом с окружающей средой;
- закрытые , в которых существует обмен энергией с окружением, но нет обмена веществом;
- изолированные , в которых нет обмена с окружением ни энергией, ни веществом.
Состояние системы описывают с помощью макроскопических параметров. Параметры бывают:
- внутренние , которые определяются только координатами тел системы, например: плотность или внутренняя энергия U;
- внешние , которые определяются координатами тел в окружающей среде, например, объем V (при фиксированном положении стенок сосуда) или напряженность электрического поля E;
- экстенсивные , которые прямо пропорциональны массе системы или числу частиц, например, объем V, энергия U, энтропия S, теплоемкость C;
- интенсивные , которые не зависят от массы системы или числа частиц, например, температура T, плотность , давление p. Отношение любых двух экстенсивных параметров является интенсивным параметром, например парциальный мольный объем V или мольная доля x.
Среди термодинамических параметров выделяют обобщенные силы и обобщенные координаты. Обобщенные силы описывают состояние равновесия. К ним относят давление p, химический потенциал , электрический потенциал , поверхностное натяжение . Обобщенные силы — интенсивные параметры.
Обобщенные координаты — это величины, которые изменяются под действием соответствующих обобщенных сил. К ним относятся объем V, количество вещества n, заряд e, площадь W . Все обобщенные координаты — экстенсивные параметры.
Состояние системы описывается также с помощью термодинамических функций, которые зависят от параметров. Различают:
- функции состояния , которые зависят только от состояния системы и не зависят от пути, по которому это состояние получено;
- функции перехода , значение которых зависит от пути, по которому происходит изменение системы.
Примеры функций состояния: энергия U, энтальпия H, энергия Гельмгольца F, энергия Гиббса G, энтропия S. Термодинамические параметры объем V, давление p, температуру T также можно считать функциями состояния, т.к. они однозначно характеризуют состояние системы. Примеры функций перехода: теплота Q и работа A.
Функции состояния характеризуются следующими свойствами:
- бесконечно малое изменение функции f является полным дифференциалом (обозначается df);
- изменение функции при переходе из состояния 1 в состояние 2 определяется только этими состояниями:
;
- в результате любого циклического процесса функция состояния не изменяется:
Параметры системы могут зависеть или не зависеть от времени. В зависимости от этого различают следующие состояниятермодинамических систем:
- стационарное , когда параметры системы не зависят от времени, но в системе есть потоки (например, массы или энергии);
- равновесное , когда параметры системы не зависят от времени и нет потоков;
- неравновесное , когда параметры системы зависят от времени.
Если хотя бы один из параметров системы меняется со временем, то говорят, что в системе происходит процесс. Процессы бывают:
- обратимые , когда переход системы из одного состояния в другое и обратно может происходить по одному и тому же пути, и после возвращения в исходное состояние в окружающей среде не остается макроскопических изменений;
- квазистатические , или равновесные, которые происходят под действием бесконечно малой разности обобщенных сил;
- необратимые , или неравновесные, когда параметры меняются с конечной скоростью.
Все выводы и соотношения термодинамики основаны на двух постулатах (исходных положениях) и трех законах (началах).
Первое исходное положение, или основной постулат термодинамики:
Любая изолированная система с течением времени приходит в равновесное состояние и самопроизвольно не может из него выйти.
Это положение ограничивает размер систем, которые описывает термодинамика. Оно не выполняется для систем астрономического масштаба и микроскопических систем с малым числом частиц. Системы галактического размера самопроизвольно не приходят в состояние равновесия благодаря дальнодействующим гравитационным силам. Микроскопические системы могут самопроизвольно выходить из состояния равновесия; это явление называют флуктуациями. В статистической физике показано, что отклонение от положения равновесия имеет амплитуду порядка 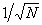
Переход системы в равновесное состояние называют релаксацией. Основной постулат термодинамики ничего не говорит о времени релаксации. В классической равновесной термодинамике вообще нет времени. Термодинамика позволяет установить только возможность протекания процессов, но не может определить скорость этих процессов.
Второе исходное положение, или нулевой закон термодинамики описывает свойства систем, находящихся в состоянии теплового равновесия:
Если система А находится в тепловом равновесии с системой В, а та, в свою очередь, находится в равновесии с системой С, то системы А и С также находятся в тепловом равновесии.
Это свойство говорит о существовании особого интенсивного параметра, характеризующего состояние теплового равновесия. Этот параметр называют температурой. Системы, находящиеся в тепловом равновесии, имеют одинаковую температуру. Таким образом, нулевой закон — это постулат о существовании температуры.
Из нулевого закона следует, что при равновесии внутренние параметры системы являются функциями внешних параметров и температуры. Уравнение, связывающее внутренние параметры с внешними параметрами и с температурой, называют уравнением состояния термодинамической системы. В общем случае уравнение состояния имеет вид:
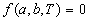
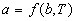
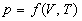
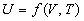
Если известны термическое и калорическое уравнения состояния, то с помощью законов термодинамики можно определить все термодинамические свойства системы, т.е. получить ее полное термодинамическое описание. Сами уравнения состояния нельзя вывести методами классической термодинамики, но их можно определить экспериментально.
Простейшее уравнение состояния описывает систему невзаимодействующих частиц точечного размера — идеальный газ:
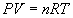
R = 8.314 Дж/(моль . К) = 1.987 кал/(моль . К) = 0.0821 л . атм/(моль . К).
Для описания реальных газов, в которых частицы имеют конечные размеры и взаимодействуют друг с другом, используют более сложные уравнения состояния:
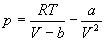
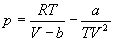
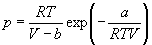
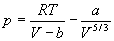
Все эти уравнения записаны для одного моля газа; величины a и b — индивидуальные постоянные газов.
С высокой точностью поведение любого реального газа можно описать с помощью вириального разложения по степеням обратного объема:
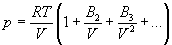
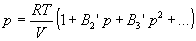
где Bi, Bi‘ — i-ые вириальные коэффициенты, которые зависят от температуры.
Уравнение состояния идеального газа и вириальное уравнение состояния реального газа можно вывести методами статистической термодинамики.
Иногда уравнения состояния реальных газов записывают через так называемые приведенные переменные, которые определяют через параметры критического состояния газов: pr = p / pкр, Vr = V / Vкр, Tr = T / Tкр, где критические параметры определяются как координаты точки перегиба на изотерме реального газа:
ПРИМЕРЫ
Пример 1-1. Докажите, что при больших объемах уравнение Ван-дер-Ваальса переходит в уравнение идеального газа.
Решение. Уравнение Ван-дер-Ваальса:
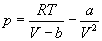
При больших объемах вторым слагаемым в правой части можно пренебречь: a/V 2 0. В знаменателе первого слагаемого можно пренебречь постоянной b: V—b V. В пределе получаем уравнение идеального газа:
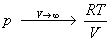
Пример 1-2. Найдите вириальные коэффициенты Bi для газа, подчиняющегося уравнению Ван-дер-Ваальса.
Решение. В уравнении Ван-дер-Ваальса выделим сомножитель RT/V:
Если разложить первое слагаемое в скобке в ряд по степеням b/V, получим:
Из этого разложения следует, что второй вириальный коэффициент газа Ван-дер-Ваальса зависит от температуры:
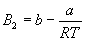
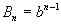
Пример 1-3. Найдите критические параметры и приведенное уравнение состояния для газа Дитеричи (I уравнение).
Решение. Запишем уравнение Дитеричи в виде:
и продифференцируем левую и правую часть этого уравнения два раза по объему при постоянной температуре:
и учтем, что в критической точке первая и вторая производная равны 0:
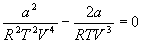
откуда находим: 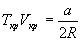
Если продифференцировать обе части уравнения состояния по объему один раз с учетом равенства нулю первой производной, то можно найти второе соотношение между критическими объемом и температурой:
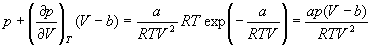
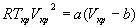
Подставляя сюда первое найденное соотношение для критических параметров, получим:
И, наконец, подставляя эти параметры в уравнение состояния, находим критическое давление:
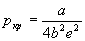
Для вывода приведенного уравнения состояния подставим в уравнение Дитеричи приведенные переменные:
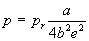
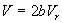
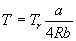
В результате получаем приведенное уравнение Дитеричи, не содержащее индивидуальных параметров:
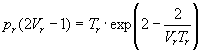
ЗАДАЧИ
1-1. Приведите пример термодинамического процесса, который может совершаться как обратимо, так и необратимо. Назовите для этого процесса по одной функции состояния и перехода.
1-2. Приведите примеры систем со временем релаксации порядка: а) секунд; б) часов; в) десятилетий.
1-3. Изменение теплоты в зависимости от температуры и объема в некоторой системе описывается уравнением:
(C и R — постоянные). Является ли теплота функцией состояния в данном случае? Ответ обоснуйте.
1-4. Докажите, что при больших объемах первое уравнение Дитеричи переходит в уравнение идеального газа.
1-5. Найдите частные производные 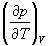
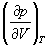
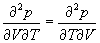
1-6. Используя вириальные разложения (1.4) и (1.5), найдите связь между вириальными коэффициентами B2, B3 и B2‘, B3‘.
1-7. Найдите критические параметры и приведенные уравнения состояния для газов: а) Ван-дер-Ваальса; б) Бертло.
1-8. Предложено следующее уравнение состояния (для одного моля):
Выразите критические параметры через постоянные B и C и найдите фактор сжимаемости PV/RT в критической точке.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
http://zdamsam.ru/a23734.html
http://www.chem.msu.su/rus/teaching/eremin1/1-1.html



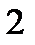






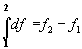 ;
;