Вязкость дисперсных систем
Важной характеристикой структурно-механических свойств является течение. Течение бывает ламинарным и турбулентным.
Ламинарное течение – движение жидкости в виде параллельных слоев, имеющих различную скорость и не смещающихся между собой. Возникает при низкой скорости течения и малом перепаде давления.
Турбулентное течение – течение, сопровождающееся вихреобразованием.
В соответствие с уравнением Ньютона сила сопротивления при течении F прямо пропорциональна градиенту скорости du и площади поверхности потока S:
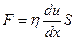
где η – коэффициент пропорциональости или вязкость, зависит от природы жидкости Единицей измерения вязкости является пуаз (пз), 1 пз = Па∙с= Н∙с/м 2 . Единица измерения вязкости названа в честь франц. учёного Пуазейля, который впервые изучал движение жидкости в капиллярах.
Ламинарное течение по трубкам или скорость течения жидкости из капилляра описывается уравнением Пуазейля (1842г.), которое было найдено экспериментальным путём:
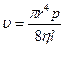
где u — объемная скорость течения;
r – радиус капилляра трубки;
Δp – перепад давления или разность давления на обоих концах трубки;
Η – вязкость жидкости;
l – длина капилляра.
Величина, обратная вязкости 

Жидкости, у которых отсутствует зависимость вязкости от характера взаимодействия частиц, подчиняются законам Ньютона и Пуазейля и называются ньютонскими жидкостями. Уравнение Ньютона и Пуазейля соблюдается, если жидкость движется ламинарно.
Вязкость дисперсных систем всегда превышает вязкость чистой дисперсионной среды. Зависимость вязкости коллоидной системы от концентрации дисперсной фазы выражается уравнением Эйнштейна (1906г.):
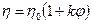
где η – вязкость коллоидной системы;
η0 – вязкость чистого растворителя (дисперсионной среды);
φ – объемная доля частиц дисперсной фазы;
k – коэффициент, характеризующий форму частицы. Для сферической формы k = 2,5.
Для структурированных систем законы Ньютона не выполняются.
Лекция №13.
План лекции:
ПРОЧНОСТЬ И ВЯЗКОСТЬ ДИСПЕРСНЫХ СИСТЕМ
Вязкие тела текут при любом напряжении сдвига t ( R t ) :
F — сила вязкого сопротивления, В — площадь, на которую распространяется действие этой силы.
Течение вязких тел определяется законом Ньютона:
Р t = h ( d g / d P t ) , F = h В( d g / d P t ) (13.2)
где h — коэффициент вязкости, d g / d P t -изменение деформации сдвига во времени (скорость деформации).
Если обозначить скорость деформации через g . , то вязкость системы:
Вязкость свободнодисперсных систем растет по мере увеличения концентрации дисперсной фазы. Присутствие частиц дисперсной фазы приводит к искажению потока жидкости вблизи этих частиц, что влияет на вязкость. Если концентрация незначительна и столкновения исключаются, то характер движения жидкости около одной частицы не влияет на характер движения жидкости около другой частицы. В этих условиях для определения вязкости свободнодисперсных систем можно воспользоваться уравнением Эйнштейна:
h , h 0 — вязкость свободнодисперсной системы и дисперсионной среды, u об — объемная концентрация дисперсной фазы, к — коэффициент, зависящий от формы частиц (для сферической формы к = 2,5).
Формула Эйнштейна справедлива при отсутствии деформации частиц, если концентрация дисперсной фазы не превышает 6%.
При увеличении объемной концентрации до 30% можно пользоваться формулой:
При сопоставлении формул 13.4 и 13.5 видно, что по мере увеличения концентрации частиц линейная зависимость между вязкостью и
концентрацией нарушается. Тем не менее, вязкость подобных систем при данной концентрации остается постоянной. Подобные системы называются ньютоновскими.
Течение и вязкость неньютоновских жидкостей, которые называют еще аномальными жидкостями, зависят от внешнего воздействия (напряжения сдвига). Вязкость является величиной переменной для данной концентрации и уже не определяется соотношениями 13.2 и 13.3.
Рассмотрим особенности движения структурированных систем (рис.13.1).
Рис.13.1.Зависимость скорости течения (а) и коэффициента вязкости (б) от внешнего усилия Р.
Р r — предел прочности, Рх1 — предел упругости, Рх2 -условный предел прочности, Р m — напряжение полного разрушения структуры, h макс — вязкость неразрушенной структуры, h мин — наименьшая вязкость предельно разрушенной структуры.
Кривые h = f (Р) — полные реологические кривые течения структурированных дисперсных систем. Каждое значение вязкости на этих кривых соответствует равновесному состоянию систем в стационарном ламинарном потоке.
Четыре состояния структурированных систем:
1. 0 P Р x1 (Р x1 — предел упругости). В этом состоянии течение отсутствует, и внешнее воздействие не может нарушить прочность системы.
2. Р > Р x 1 — система начинает течь. Скорость перемещения незначительна, связи между частицами после их разрушения успевают восстановиться. Структура не разрушается. Подобное перемещение называют ползучестью. Вязкость системы в данной зоне наибольшая. Скорость движения в данной зоне:
к — коэффициент, характеризующий структурные особенности дисперсной системы.
Необратимое разрушение системы начинается на границе зон 2 и 3, а на границе участков 3 и 4 оно заканчивается. В этом состоянии дисперсной системы связи между частицами не восстанавливаются, вязкость снижается, скорость движения системы увеличивается. Для этого случая скорость системы:
На участке 4 структура разрушается полностью, минимальная вязкость — полное разрушение системы. На рисунке приведены реологические кривые для твердообразных тел, для жидкообразных систем — пунктирная линия 1а.
Изменение вязкости структурированных жидкостей широко используется на практике.
ВИДЫ ДИСПЕРСНЫХ СИСТЕМ. ЗОЛИ И СУСПЕНЗИИ
Золи и суспензии, а также их производные — гели и пасты — разновидности одного и того же типа дисперсных систем — Т/Ж, различаются они размером частиц дисперсной фазы.
Золи — высокодисперсные системы, их называют еще коллоидными растворами. В зависимости от дисперсионной среды делятся на гидрозоли (вода) и органозоли (органическая среда).
Помимо твердых частиц, дисперсная фаза золей может формироваться из мицелл — электрически нейтральных агрегатов ионов дисперсной среды.
Суспензии — средне- и грубодисперсные системы.
Золи — седиментационно-устойчивые системы, суспензии — седиментационно-неустойчивы.
Особенно резко различаются оптические свойства золей и суспензий. Золи способны рассеиваться по закону Рэлея, а действие света на суспензии происходит по законам геометрической оптики.
Общие свойства золей и суспензий определяются границей раздела фаз Т/Ж, на которой происходят адсорбционные процессы и образуется ДЭС. Больший размер частиц у суспензий приводит к тому, что электроосмос, потенциал седиментации и течения у них выражен слабо, а электрофорез — отсутствует.
ПАСТЫ, ГЕЛИ И ОСАДКИ
При увеличении концентрации частиц дисперсной фазы системы из свободнодисперсных превращаются в связанодисперсные. Связнодисперсные системы, в которые переходят суспензии, называются пастами. Золи переходят в гели. Пасты и гели образуют структуры, для них характерны структурно-механические свойства.
Пасты — концентрированные суспензии или осадок, который образуется при потере суспензией седиментационной устойчивости. Кроме того, пасты могут быть приготовлены искусственно путем растирания твердых тел в жидкой среде.
Осадки золей могут переходить обратно в коллоидный раствор — пептизация (процесс, обратный коагуляции — распад агрегатов до первичных частиц).
Пептизация может протекать под действием электролитов, при этом восстанавливается ДЭС, повышается дзета-потенциал, а силы электростатического отталкивания преобладают над силами межмолекулярного взаимодействия. Пептизация может также происходить под действием растворов ПАВ, молекулы которых адсорбируются на границе раздела фаз и образуют адсорбционные слоя, которые противодействуют сближению частиц.
Пептизация протекает с определенной скоростью и зависит от концентрации электролита-пептизатора (рис.13.2)
SHAPE \* MERGEFORMAT
Рис.13.2.Изменение массы перешедшего в раствор осадка в зависимости от концентрации пептизатора.
В начале процесса при незначительной концентрации пептизатора перехода осадка в раствор не т (участок 1) — происходит адсорбция пептизатора на поверхности частиц. По мере увеличения концентрации пептизатора (участок 2) количество осадка, перешедшего в коллоидный раствор, возрастает. При дальнейшем увеличении концентрации пептизатора весь осадок переходит в коллоидный раствор (участок 3).
Зависимость вязкости раствора от объемной концентрации частиц. Уравнение Эйнштейна.
Эйнштейн установил зависимость вязкости раствора от концентрации
где j – объемная доля дисперсной фазы; a – коэффициент, зависящий от формы частиц. Для частиц шарообразной формы a = 2,5; для частиц удлинненой формы a >2,5. Это уравнение выведено в предположении, что частицы дисперсной фазы много больше молекул растворителя, они удалены друг от друга, имеют одинаковые размеры и форму и не взаимодействуют.
10.Предметом химической термодинамики является изучение
превращений энергии в химических процессах. Она рассматривает тепловые эффекты химических реакций, фазовые переходы индивидуальных веществ и смесей, химические равновесия.
Системойбудем называть тело или группу тел, отделенных от окружающей среды реальной или мысленной границей. Система называется термодинамической если между ее элементами происходит обмен энергией, веществом.
В зависимости от характера взаимодействия с окружающей средой
различают системы открытые, закрытые и изолированные.
Открытаясистема может обмениваться с окружающей средой и энергией, и веществом, закрытая– только энергией, а изолированная не обменивается ничем.
Фаза – это часть системы, отделенная от других частей системы
поверхностью раздела фаз и характеризующаяся одинаковыми физико-
химическими свойствами во всех ее точках. Если система состоит из одной фазы, она называется гомогенной, если из нескольких фаз – это
гетерогенная система. Совокупность всех физических и химических свойств системы характеризует ее термодинамическое состояние.
Состояние системы определяется термодинамическими параметрами(свойствами), которыеможно экспериментально измерить. Опытным путем устанавливается, чтодля однозначной характеристики данной системы необходимо использоватьнекоторое число параметров, называемых независимыми, все остальныепараметры состояния системы рассматриваются как функции независимыхпараметров. Функции параметров состояния, которые нельзяэкспериментально измерить (внутренняя энергия, энтальпия, энтропия и др.)называютфункциями состояния.Параметры, значения которых не зависят отмассы (температура, давление, плотность, концентрация и др.), называются
интенсивными. В противоположность им экстенсивные параметры зависят от массы (объем, масса, внутренняя энергия, теплоемкость и др.).
Важно отметить, что параметры и функции состояния системы
характеризуют лишь систему в данный момент времени и ничего не говорят о ее предшествующих состояниях.
11. Первый закон (начало) термодинамикиявляется следствием закона сохранения энергии и имеет несколько формулировок:
– энергия изолированной системы постоянна;
– вечный двигатель первого рода (работающий без затрат энергии)
– энергия не исчезает и не возникает из ничего, переход ее из одного
вида в другой происходит в строго эквивалентных количествах.
Первое начало термодинамики является постулатом, т.е. оно не может
быть доказано или выведено из каких-либо более общих соображений. Его
истинность подтверждается тем, что ни одно из его следствий не находится в противоречии с опытом. Из последнего определения следует
Q = ∆U + A т. е. подводимое к системе тепло идет на изменение ее внутренней энергии и на совершение ею работы. Механическая работа газов A = p’V. Таким образом, если реакция протекает при постоянном объеме, то Q = ∆U, а при постоянном давлении Q = ∆U + p∆V = ∆Н.
12.
функция состояния энтропия S характеризует процесс
рассеивания энергии. Понятие об энтропии, как меры рассеяния тепловой
энергии, ввел Клаузиус, рассматривая цикл Карно, для к.п.д. которого можно записать выражение h = (Q 1 – Q 2 )/Q 1 = (T 1 – T 2 )/T 1
где Q 1 — теплота, полученная системой от нагревателя температурой Т 1 , а Q 2– теплота, отданная системой нагревателю при температуре Т 2 .
Но любой произвольный цикл можно представить как
сумму бесконечно малых циклов Карно. Это означает, что для произвольного цикла S dQ/ T = 0, и существует функция состояния S, для которой dS = dQ/T.
Это выражение второго закона термодинамики для произвольного
обратимого процесса. Для необратимого процесса знак равенства заменяется на неравенство и в общем случае dS = dQ/ T.
Любая форма энергии может полностью перейти в теплоту, тогда как
теплота может преобразоваться в энергию лишь частично.
Существует несколько формулировок второго начала:
– теплота не может самопроизвольно переходить от более холодного
тела к более горячему (Клаузиус);
– вечный двигатель второго рода (который превращает всю теплоту в
работу) невозможен (Оствальд).
13.Для химии следствием первого начала термодинамики
является закон Гесса:
Тепловой эффект реакции не зависит от пути процесса и
определяется только конечным и начальным состоянием.
Если мы проводим реакцию от исходных веществ к продуктам
напрямую с тепловым эффектом DН 1 , затем двумя последовательными
реакциями с тепловыми эффектами DН 2 и DН 3
реагенты ∆H1 продукты
Тепловые эффекты реакций изучает специальный раздел физической
химии – термохимия.
В термохимических расчетах используют ряд следствий из закона Гесса:
1. Тепловой эффект прямой реакции равен по величине и
противоположен по знаку тепловому эффекту обратной реакции (закон
2. Для двух реакций, имеющих одинаковые исходные, но разные
конечные состояния, разность тепловых эффектов есть тепловой эффект
перехода из одного конечного состояния в другое. Например,
3. Для двух реакций, имеющих разное исходное, но одинаковое конечное
состояние, разность тепловых эффектов равна теплоте перехода из одного
исходного состояния в другое. Например,
4. Тепловой эффект реакции при стандартных условиях равен
разности между стандартными теплотами образования продуктов и
реагентов, умноженных на соответствующие стехиометрические
5. Тепловой эффект реакции при стандартных условиях равен
разности между стандартными теплотами сгорания реагентов и
продуктов, умноженных на соответствующие стехиометрические
14. Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Тепловой эффект рассчитывается из первого закона термодинамики. (№11)
Стандартная энтальпия сгорания — ΔHгор о , тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю.
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции (следствиезакона Гесса):
15.Изменение энтропии не зависит от пути процесса и определяется
только начальным и конечным состояниями
где интегрирование проводится от начального до конечного состояния. Для
обратимого процесса dQ = С Р dT, где С р – теплоемкость при постоянном
давлении. Подставив это выражение в (1) и выполнив интегрирование
получим выражение для энтропии при температуре Т
S T = S 0 + ∫ (С Р /T)dT
В термодинамических расчетах используют стандартную
энтропию S0 (энтропия при стандартных условиях). Изменение стандартной
энтропии в химических реакциях ∆S 0 (точно также как и изменение
энтальпии) равно разности между стандартными энтропиями продуктов и
реагентов, умноженных на соответствующие стехиометрические
16.Энтропия определяет направление процесса в изолированной системе.
Для закрытых систем аналогичными функциями являются
термодинамические потенциалы: потенциал (энергия) Гиббса (G) и потенциал
Потенциал Гиббса характеризует часть энергии системы, которая может быть превращена в работу в изобарно-изотермических условиях. Аналогично – потенциал Гельмгольца – для изохорно-изотермических условий.
17.Для самопроизвольного процесса в изобарно-изотермических условиях DH £ 0, а DS = 0, т.е., энергия стремится к минимуму, а беспорядок – к максимуму. Это и учитывает потенциал Гиббса. Его изменение
Если для какого-либо процесса DG 0 – возможен обратный процесс. Если DG = 0,
система находится в положении равновесия. Все это относится и к
химическим реакциям. Чтобы определить направление химической реакции,
надо определить для нее знак DG. Для этого необходимо вычислить значения
∆H 0 и ∆S 0 , затем определить их значения при нужной температуре по
приведенным выше формулам и, наконец, вычислить величину ∆G. Задача
сильно упрощается, если надо определить направление процесса при
18. Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. А2 + В2 ⇄ 2AB
Факторы влияющие на химическое равновесие:
1) температура При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
2) давлениеПри увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
http://www.trotted.narod.ru/collchem/lec-13.htm
http://lektsii.org/9-46785.html


