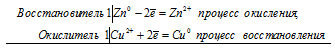Процессы коррозии различных металлов. Интенсивность коррозии
Решение задач по химии на коррозию металлов
Задание 296
Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
Решение:
Если цинковую или медную пластинки опустить в раствор сульфата меди, то в обоих случаях будет наблюдаться выпадение осадка меди. Происходит вытеснение меди цинком и железом, потому что стандартные электродные потенциалы цинка (-0,763 В) и железа (-0,44 В) значительно электроотрицательнее, чем потенциал меди (+0,34 В). Поэтому цинк и железо будут окисляться, а ионы меди Cu 2+ — восстанавливаться до металлической меди:
а) Электрохимические процессы при реакции цинка и сульфата меди
Zn 0 + Сu 2+ = Zn 2+ + Cu 0
б) Электрохимические процессы при реакции железа и сульфата меди
Fe 0 + Сu 2+ = Fe 2+ + Cu 0
Если соединить цинковую и железную пластинки, опущенные в раствор сульфата меди (II) проводником, то будет наблюдаться растворение цинковой пластинки и осаждение меди на железной пластинке. Объясняется это тем, что цинк имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому цинк будет окисляться. На железной пластинке будут восстанавливаться ионы меди, так как стандартный электродный потенциал меди имеет большее численное значение, чем потенциал железа.
Анодный процесс: Zn 0 -2 
Катодный процесс: Cu 2+ + 2 
Задание 297
Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
Решение:
Стандартные электродные потенциалы железа и цинка равны соответственно -0,44 В и -0,763 В. Потенциал, отвечающий электродному процесс:
2Н + + 2 
В нейтральной среде, равен приблизительно -0,41 В. Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислять только те металлы, потенциал которых меньше, чем -0,41 В, — это могут быть железо и цинк. Однако, эти металлы в нейтральных растворах, содержащих растворённый кислород, образуют защитную оксидную плёнку, препятствующую дальнейшему разрушению металла. Поэтому железо и цинк не могут быть окислены ионами водорода в нейтральных средах. Атмосферная коррозия – коррозия во влажном воздухе при комнатной температуре. Поверхность металла, находящегося во влажном воздухе, бывает покрыта плёнкой воды, содержащей различные газы, и в первую очередь – кислород. Скорость атмосферной коррозии зависит от рН среды. При понижении рН среды концентрация ионов водорода Н+ возрастает, что приводит к увеличению скорости коррозии металла, увеличивается восстановительный процесс на аноде:
2Н + + 2 
При повышении рН раствора уменьшается концентрация ионов водорода Н + и, соответственно, увеличивается концентрация ионов ОН-, что, согласно принципу Ле Шателье, смещает равновесие в системах: 2Н + + 2 

Электрохимические процессы, протекающие при контакте железа и цинка при контакте с водой с поглощением кислорода (атмосферная коррозия):
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Задание 298
В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Если цинковую пластинку опустить в раствор электролита, содержащего растворенный кислород, то будет наблюдаться коррозия цинка, характеризующаяся окислением его до ионов Zn 2+ :
Zn 0 -2 
Чрез некоторое время скорость реакции заметно замедляется, потому что чистый цинк окисляется кислородом, растворённым в воде, с образованием оксидной плёнки, которая, покрывая пластинку тонким слоем, пассивирует её. При этом протекает реакция:
Zn + 1/2 O2 = Zn 0
б) Если в раствор электролита опустить цинковую пластинку частично покрытую медью, процесс коррозии будет происходить значительно интенсивнее, так как образуется гальваническая пара Zn — Cu. Цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (0,34 В), поэтому цинк является анодом, а медь – катодом.
Анодный процесс: Zn 0 -2 
Катодный процесс: в кислой среде: 2Н + + 2 

В нейтральной среде или в щелочной ионы цинка Zn 2+ с гидроксид-ионами ОН- образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2. В кислой среде ионы цинка Zn 2+ с ионами кислотного остатка будут образовывать соль и при этом выделяется газообразный водород. Происходит интенсивное разрушение цинковой пластинки частично покрытой медью.
Объясните, составив уравнение реакций, процессы, происходящие при электрохимической коррозии, если : а)железо покрыто цинком?
Химия | 5 — 9 классы
Объясните, составив уравнение реакций, процессы, происходящие при электрохимической коррозии, если : а)железо покрыто цинком.
Б)алюминий покрыт магнием.
А) Fe, Zn коррозия это явление, при котором более активный металл реагирует с кислородом воздуха, окисляясь и разрушая изделие.
У меня таблица слегка неудобная, ты посмотри, какой элемент в ряду напряжений металлов стоит левее, ближе к литию и калию и запиши реакцию с тем : 2Fe + O2 = > ; 2FeO или 2Zn + O2 = > ; 2ZnO
Магний активнее, чем алюминий, поэтому он реагирует с кислородом : 2Mg + O2 = > ; 2MgO в итоге разрушается слой магния, а алюминий остается.
Таким образом, металлические изделия защищают от коррозии — сверху наносят слой более активного металла.
Составьте уравнение электродных процессов и молекулярное уравнение реакции, Протекающей при электрохимической коррозии гальванопары Fe — Sn в атмосфере влажного воздуха?
Составьте уравнение электродных процессов и молекулярное уравнение реакции, Протекающей при электрохимической коррозии гальванопары Fe — Sn в атмосфере влажного воздуха.
Составьте электронные уравнения коррозии железа, покрытого цинком, и железа, покрытого свинцом в кислой среде и во влажном воздухе?
Составьте электронные уравнения коррозии железа, покрытого цинком, и железа, покрытого свинцом в кислой среде и во влажном воздухе.
Что такое электрохимическая коррозия?
Что такое электрохимическая коррозия.
Опишите признаки реакций, происходящих при коррозии железа, бронзы, серебра?
Опишите признаки реакций, происходящих при коррозии железа, бронзы, серебра.
Помогите составить уравнения реакций :1) цинк — — оксид цинка — — хлорид цинка — — гидроксид цинка — — оксид цинка2) натрий — — гидроксид натрия — — гидроксид железа (III) — — нитрат железа (II) — — н?
Помогите составить уравнения реакций :
1) цинк — — оксид цинка — — хлорид цинка — — гидроксид цинка — — оксид цинка
2) натрий — — гидроксид натрия — — гидроксид железа (III) — — нитрат железа (II) — — нитрат калия
3) магний — — оксид магния — — нитрат магния — — гидроксид магния — — хлорид магния
Составте уравнения реакции, которве протекают при коррозии железа, покрытого влагой?
Составте уравнения реакции, которве протекают при коррозии железа, покрытого влагой.
Какое покрытие металла называется анодным и какое катодным?
Какое покрытие металла называется анодным и какое катодным?
Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа.
Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в серной кислоте Что является продуктом коррозии?
Железное изделие покрыли кадмием какое это покрытие — анодное или катодное?
Железное изделие покрыли кадмием какое это покрытие — анодное или катодное?
Составьте уравнения электродных процессов, происходящих при нарушении покрытия во влажном воздухе и кислой среде.
Напишите продукты корозии.
Составьте уравнение электрохимической коррозии Fe — Cu в нейцтральной среде и в растворе соляной кислоты?
Составьте уравнение электрохимической коррозии Fe — Cu в нейцтральной среде и в растворе соляной кислоты.
В каком случае алюминий лучше защищён от коррозии, при покрытии его цинком или магнием?
В каком случае алюминий лучше защищён от коррозии, при покрытии его цинком или магнием?
Аргументируйте свой ответ.
На этой странице вы найдете ответ на вопрос Объясните, составив уравнение реакций, процессы, происходящие при электрохимической коррозии, если : а)железо покрыто цинком?. Вопрос соответствует категории Химия и уровню подготовки учащихся 5 — 9 классов классов. Если ответ полностью не удовлетворяет критериям поиска, ниже можно ознакомиться с вариантами ответов других посетителей страницы или обсудить с ними интересующую тему. Здесь также можно воспользоваться «умным поиском», который покажет аналогичные вопросы в этой категории. Если ни один из предложенных ответов не подходит, попробуйте самостоятельно сформулировать вопрос иначе, нажав кнопку вверху страницы.
1) NaOH + H2 2) ZnS 3) ZnO 4) ZnCl2 + H2 5) ZnCl2 + Fe 6) Mg(OH)2 + H2 7) Mg3P2 8) — 9) MgCl2 10) — 11) MgSO4 + Ni 12) AlBr3 13) Al2(SO4)3 + Fe 14) AlI3 + H2.
FeO + P = Fe + P2O5 1)восстановитель Fe (в степени — 2) – 2е = Fe (в нулевой степени) 2)окислитель Р (в нулевой степени) + 5е = P (в степени + 5).
Химия используется при уборке в доме , мытьё посуды . В сельской хозяйственности для орошения полей от вредителей . В медецине для создания лекарств .
Ba — металлическая BaBr2 — ионная HBr — ковалентная полярная Br2 — ковалентная не полярная.
Ba — металлическая HBr — Ковалентная полярная Br2 — ковалентная не полярная BaBr2 — ионная.
Ми знаємо формулу знаходження масової частки елемента в речовині і у цю формулу підставляємо значення, знаходимо скількі атомів Оксигена у формулі .
В этих местах останутся желтые пятна, а потом они станут оранжевые.
2Al(OH)3 = Al2O3 + 3H2O H2CO3 = CO2 + H2O CACO3 = CAO + CO2( газ) CU(OH)2 = CUO + H2O Zn + 2HCl = ZnCl2 + H°2(газ) Ca° + H2SO4 = CaSO4 + H°2(газ) 3Mg° + 2H3PO4 = Mg3(PO4)2 + H°2(газ) 2Al° + Fe2O3 = Al2O3 + 2Fe° Cu(No3) + NaOH = Cu(OH) (осадок) + NaNo..
2Al(OH)3 — — >Al2O3 + 3H2O H2CO3 — — >CO2 + H2O CaCO3 — — >CaO + CO2 Cu(OH)2 — — >CuO + H2O Zn + 2HCL — — >ZnCL2 + H2 Ca + H2SO4 — — >CaSO4 + H2 3Mg + 2H3PO4 — — >Mg3(PO4)2 + 3H2 2Al + Fe2O3 — — >2Fe + Al2O3 Cu(NO3)2 + 2NaOH — — >Cu(OH)2 + 2NaNO3 HNO..
Вещества : вода, медь Тела : льдина , ваза, труба, гвоздь, сосулька.
Железо покрыто цинком уравнение реакции
8.2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Причиной электрохимической коррозии * является возникновение на поверхности металла короткозамкнутых гальванических элементов *.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом *. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микр о- , а макрогальванопара , и коррозия называется контактной (см. детальную классификацию видов коррозии). Сочетания металлов, сильно отличающихся значениями электродных потенциалов *, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка.
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите * (рисунок 8.1). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окислен ия ио ны переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 8.1 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов *, и работа коррозионного гальванического элемента прекратится.
Рисунок 8.1 – Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере Имеется в виду атмосфера с примесью газообразного HCl. . В этом случае железо будет анодом ( E ° = –0,44В), а медь – катодом ( E ° =+0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризац ии ио нами водорода, которые присутствуют в электролите:
А: Fe – 2e → Fe 2+ – окисление
К: 2 H + + 2e → H2 ↑ – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
A (–) Fe | HCl | Cu (+) К
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe 2+ – окисление
(К) 2 H2O + O2 + 4e → 4 OH – – восстановление
У поверхности металла в электролите протекают следующие реакции:
Fe 2+ + 2 OH – → Fe( OH)2
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Коррозия металла в результате неравномерного доступа кислорода . Случаи электрохимической коррозии, возникающей вследствие неравномерной аэрации кислородом различных участков металла, очень часто встречаются в промышленности и в подземных сооружениях. Примером может служить коррозия стальной сваи, закопанной в речное дно (рис 8.2).
Рисунок 8.2 – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет выполнять роль катода. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
http://himia.my-dict.ru/q/1111729_obasnite-sostaviv-uravnenie-reakcij-processy-proishodasie/
http://www.chem-astu.ru/chair/study/genchem/r8_2.htm