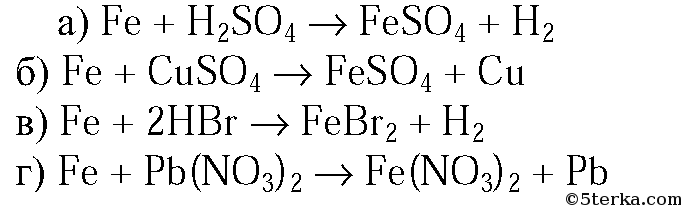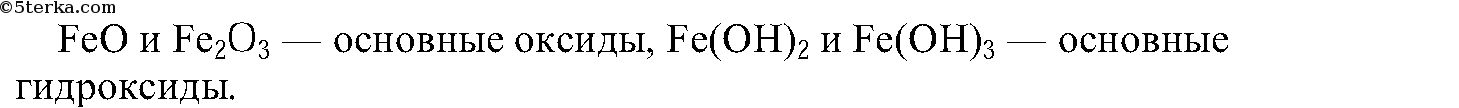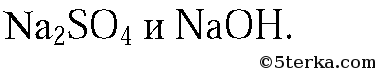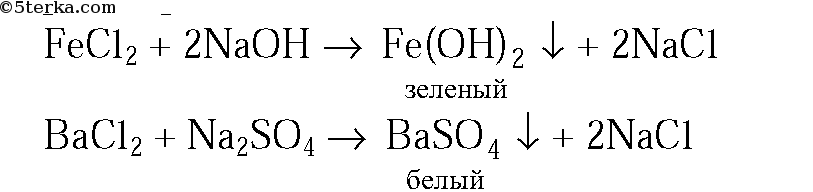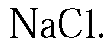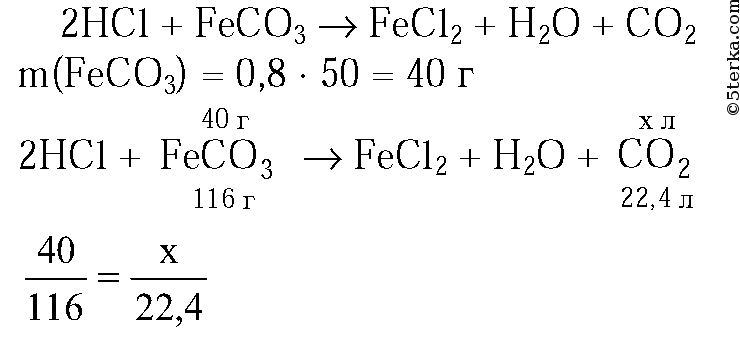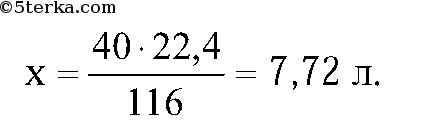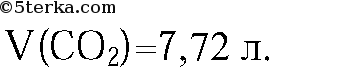Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6dfc694d29fe1610 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Подробный разбор задач (задание 33 экзамена)
Задача 3. Медный купорос ( CuSO4·5H2O ) массой 12,5 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 5,6 г железа и после завершения реакции еще 117 г 10%-ного раствора сульфида натрия. Определите массовую долю сульфида натрия в конечном растворе.
Источник: Я сдам ЕГЭ. Типовые задания. А.А. Каверина, стр. 210.
Решение:
1. Посчитаем количество веществ сульфата меди (II) в растворе и железа:
M(CuSO4) = 160 г/моль
M(CuSO4·5H2O) = 250 г/моль.
n(CuSO4·5H2O) = 12,5/250 = 0,05 моль
n(CuSO4) =n(CuSO4·5H2O) = 0,05 моль
m(CuSO4 в исходном растворе) = 0,05·160 = 8 г.
n(Fe) = 5,6/56 = 0,1 моль.
2. Запишем уравнение реакции сульфата меди (II) с железом:
| CuSO4 | + | Fe |   → | FeSO4 | + | Cu |
|---|---|---|---|---|---|---|
| Было: | 0,05 моль | 0,1 моль | — | — | ||
| Стало: | — | 0,05 моль | 0,05 моль | 0,05 моль |
3. Рассчитаем исходное количество сульфида натрия:
n(Na2S) = 117·0,1/78 = 0,15 моль
| FeSO4 | + | Na2S |   → | FeS | + | Na 2 SO4 |
|---|---|---|---|---|---|---|
| Было: | 0,05 моль | 0,15 моль | — | — | ||
| Стало: | — | 0,15-0,05 = 0,1 моль | 0,05 моль | 0,05 моль |
Так как сульфат железа (II) в недостатке, в растворе останется 0,1 моль сульфида натрия.
m(Na2S) = 0,1·78 = 7,8 г.
4. Рассчитаем массу итогового раствор:
m(итогового р-ра) = m(исх. р-ра CuSO4) + m(железа, которое перешло в раствор) + m(р-ра Na2S) — m(Cu) — m(FeS)
m(исх. р-ра CuSO4) = 8/0,2 = 40 г.
m(железа, которое перешло в раствор) = 0,05 ·56 = 2,8 г.
m(ра-ра Na2S) = 117 г (по условию)
m(Cu) = 0,05 ·64 = 3,2 г.
m(FeS) = 0,05 ·88 = 4,4 г.
m(итогового р-ра) = 40 + 2,8 + 117 — 3,2 — 4,4 = 152,2 г.
Вариант 3
Вопросы:
1. Напишите уравнения реакций железа с растворами: а) серной кислоты; б) сульфата меди(II); в) бромоводородной кислоты; г) нитрата свинца.
2. Какой характер имеют оксиды железа(II) и железа(III) и соответствующие им гидроксиды?
3. В трех пронумерованных пробирках выданы растворы хлоридов натрия, бария и железа(II). Как их можно распознать? Напишите уравнения соответствующих реакций.
4. Рассчитайте массу железа, которое можно получить из 160 г оксида железа(II), содержащего 10% примеси, при его восстановлении углеродом. (Ответ: 112 г.)
Ответы и решения:
3. Предложенные вещества можно распознать при помощи растворов
В оставшейся пробирке будет

задача №3
к главе «Тема VI. Железо. Металлургия. Работа 1. Железо и его соединения».
http://chemrise.ru/theory/tasks_inorganic11/t23
http://5terka.com/node/11504