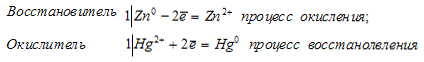Как очистить ртуть от примесей «неблагородных» металлов
Задача 1026.
Металлическая ртуть часто содержит примеси «неблагородных» металлов — цинка, олова, свинца. Для их удаления ртуть обрабатывают раствором Нg(NO 3 ) 2 . На чем основан такой способ очистки ртути?
Решение:
Способ очистки ртути от «неблагородных» металлов основан на способности металлов, расположенных в ряду напряжений до ртути, вытеснять её из растворов её же солей. Например, если ртуть обработать раствором Нg(NO3)2, то, примеси, содержащие цинк, олово и свинец, будут вытеснять ртуть из её соли и переходить в раствор в виде нитратов. Таким образом при обработке ртути Нg(NO3)2, находящиеся в ртути в виде примесей цинк, олово и свинец перейдут в раствор, а металлическая ртуть останется без примесей «неблагородных» металлов. Рассмотрим химизм процесса очистки ртути на примере цинка, получим:
Происходит реакция окисления-восстановления, в которой цинк является восстановителем, а ион ртути Hg 2+ — окислитель.
Задача 1027.
Чем объяснить малую диссоциацию хлорида ртути (II) в растворе?
Решение:
В HgСl2 преобладает ковалентная связь, потому что разность электроотрицательностей атомов Hg и Cl (Hg — Cl) равна 1,43 (2.9 – 1,47 = 1,43). Поэтому HgСl2 проявляет свойства как ковалентного соединения, так и ионного. Пары, а также кристаллы HgСl2 состоят из линейных молекул Cl — Hg — Cl, которые практически не диссоциируют в водных растворах.
Задача 1028.
Закончить уравнения реакций:
а) Zn + NaOH →
б) Zn + NaNO3 + NaOH → NH3 +
в) Hg + HNO3 (избыток) →
г) Hg (избыток) + HNO3 →
д) Hg(NO3)2 + H2S →
е) Hg(NO3)2 + KI (избыток) →
Решение:
а) Zn + 2NaOH → Na2ZnO2 + H2↑;
б) 4Zn + NaNO3 +7NaOH → NH 3 ↑ + 4Na 2 ZnO 2 + 2H 2 O:
г) 6Hg (избыток) + 8HNO3 → 3 Hg(NO 3 ) 2 + 2NO↑ + 4H2O;
Закончите уравнения возможных реакций, расставьте коэффициенты там, где нужно1) _Zn + _CaCl2 =2) _Zn + _Hg(NO3)2 =3) _Ag + _Hg(NO3)2 =4) _Fe + _AgNO3 =5) _Hg + _CuSO4 =?
Химия | 5 — 9 классы
Закончите уравнения возможных реакций, расставьте коэффициенты там, где нужно
Zn + CaCl2 — > реакция не идёт
Zn + Hg(NO3)2 — > Zn(NO3)2 + Hg
Ag + Hg(NO3)2 — > реакция не идёт
Fe + 2AgNO3 — > Fe(NO3)2 + 2Ag
Hg + CuSO4 — > реакция не идёт.
SO3 + Ca(OH)2 закончит уравнения реакции и расставьте коэффициенты?
SO3 + Ca(OH)2 закончит уравнения реакции и расставьте коэффициенты.
Закончите уравнения реакций и расставьте коэффициенты?
Закончите уравнения реакций и расставьте коэффициенты.
Закончите уравнения химических реакций и расставьте коэффициентыномер 2 и 3 помогите срочно нужно?
Закончите уравнения химических реакций и расставьте коэффициенты
номер 2 и 3 помогите срочно нужно.
Помогите с химиейЗакончите уравнения хим?
Помогите с химией
Закончите уравнения хим.
Реакций и расставьте коэффициенты.
ПОМОГИТЕ ПОЖАЛУЙСТА?
Составьте уравнение возможных реакций и Расставьте коэффициенты методом электронного баланса.
Закончите уравнения реакций, если они возможны и расставьте коэффициенты :SO3 + Al2O3 ⇒SO2 + Mg(OH)2 ⇒?
Закончите уравнения реакций, если они возможны и расставьте коэффициенты :
Закончите уравнения химических реакций, расставьте коэффициенты?
Закончите уравнения химических реакций, расставьте коэффициенты.
А) SO3 + H2O = H2SO4.
Закончите уравнения реакцый в молекулярном виде, расставьте коэффициенты, запишите их в полном ионном и сокращённом ионном виде :А)H₂SO₄ + Ba(OH)₂⇒Б)NaCl + AgNO₃⇒?
Закончите уравнения реакцый в молекулярном виде, расставьте коэффициенты, запишите их в полном ионном и сокращённом ионном виде :
Расставьте коэффициенты в уравнениях реакций?
Расставьте коэффициенты в уравнениях реакций.
Расставьте коэффициенты в уравнениях реакций ?
Расставьте коэффициенты в уравнениях реакций :
SOF2 + КОН + KBrO4 = KBr + … + … + …Закончите уравнение реакции?
SOF2 + КОН + KBrO4 = KBr + … + … + …
Закончите уравнение реакции.
Сумму коэффициентов внесите в окно :
Вы зашли на страницу вопроса Закончите уравнения возможных реакций, расставьте коэффициенты там, где нужно1) _Zn + _CaCl2 =2) _Zn + _Hg(NO3)2 =3) _Ag + _Hg(NO3)2 =4) _Fe + _AgNO3 =5) _Hg + _CuSO4 =?, который относится к категории Химия. По уровню сложности вопрос соответствует учебной программе для учащихся 5 — 9 классов. В этой же категории вы найдете ответ и на другие, похожие вопросы по теме, найти который можно с помощью автоматической системы «умный поиск». Интересную информацию можно найти в комментариях-ответах пользователей, с которыми есть обратная связь для обсуждения темы. Если предложенные варианты ответов не удовлетворяют, создайте свой вариант запроса в верхней строке.
1. m(в — ва) = m(р — ра) * n = 450 * 20% = 90 грамм m(H2O) = m(р — ра) — m(в — ва) = 450 — 90 = 360 грамм 2. 90 + 30 = 120грамм (в — ва(2)) 360 + 120 = 480грамм (раствора(2)) n = m(в — ва(2)) / m(раствора(2)) = (120 / 480) * 100% = 25%.
Ответ 3 Fe3(PO4)2 Mr = 3Fe + 2P + 😯 = 168 + 62 + 16 * 8 = 358 w (3Fe) = m элемента / m вещества = 168 / 358 = 0. 47 = 47% w(2P) = 0. 17 = 17% w(8O) = 0. 36 = 36%.
Азотная кислота — HNO3 Серная кислота — H2SO4.
ZnCl2 + Na2S = ZnS + 2NaCl.
1. C4H8 + H2 = C4H10 Бутен + водород = бутан 2. C4H10 + Cl2 = C4H9Cl + HCl Бутан + хлор = хлорбутан + хлороводород 3. 2C4H9Cl + 2Na = C8H18 + 2NaCl Хлорбутан + натрий = октан + хлорид натрия 4. C8H18 + 12. 5O2 = 8CO2 + 9H2O Октан + кислород = угл..
Это две отдельные реакции : 3ZnSO₄ + 2Na₃PO₄ = Zn₃(PO₄)₂ + 3Na₂SO₄ 3MgCl₂ + 2Na₃PO₄ = Mg₃(PO₄)₂ + 6NaCl суммарно : 3ZnSO₄ + 3MgCl₂ + 4Na₃PO₄ = Zn₃(PO₄)₂ + 3Na₂SO₄ + Mg₃(PO₄)₂ + 6NaCl.
1 — ВОРОНКА 2 — СТАКАН 3 — ? 4 — ЗАЖИМ 5 — СТЕРЖЕНЬ 6 — ПРОБИРКА 7 — ? 8 — КОЛБА 9 — ПРОБКА 10 — КОЛЬЦО Ключевое слово — Князь Игорь.
3 — бутилфенол и пентилбутаноат).
Ответ — Г ) Ar , тк слева на право радиус уменьшается.
HF фтороводородная плавиковая фторидHCl хлороводородная соляная хлоридHBr бромоводородная бромидHI иодоводородная иодидH2S сероводородная сульфидH2SO3 сернистая сульфитH2SO4 серная сульфатH2CO3 угольная карбонатH2SiO3 кремниевая силикатHNO3 азотная н..
Азотная кислота
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.
В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.
При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте.
Реакции с неметаллами
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная — до NO.
В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.
Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
Соли азотной кислоты — нитраты NO3 —
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
Нитрат аммония получают реакция аммиака с азотной кислотой.
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота — до +2.
- Реакции с металлами, основаниями и кислотами
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
http://himia.my-dict.ru/q/7548474_zakoncite-uravnenia-vozmoznyh-reakcij-rasstavte-koefficienty/
http://studarium.ru/article/170