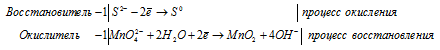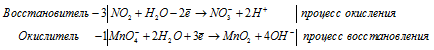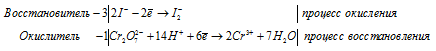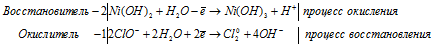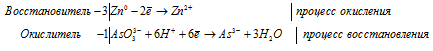Составление уравнений в ионно-молекулярной форме
S 2 — + MnO4 2- + 2H2O = MnO2 + S 0 + 4OH —
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
4K + + S 2- + MnO4 2- + 2H2O = S + MnO2 + 4K + + 4OH — .
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Для уравнивания добавим в уравнение 1 моль K2SO4, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
3Zn 0 + AsO3 3- + 6H + = 3Zn 2+ + As 3- + 3H2O.
После приведения членов обеих частей уравнения, получим:
Помогите с химией!! ! 1.С помощью метода полуреакций поставить коэффициенты в уравнение ОВР: Zn+ HNO3=Zn(NO3)2+NH4(NO3)
правильный ответ : 4Zn + 10HNO3 -> 4Zn(NO3)2 + NH4NO + 3H2O
решение:
1.окисление:
Zn=Zn(+2) (Zn poteryal 2 elektrona)
NO3(-) = NH4(+) (N poluchil 8 elektronov)
NO3(-) = NH4(+) + 3H2O (chtoby O byl raven do i posle reakcii)
NO3(-) +10H(+) = NH4(+) + 3H2O (dobavlyaem 10H+ chtoby H+ byli ravni do i posle)
Vmeste:
Zn + 10H(+) + NO3(-) -> NH4(+) + 3H2O + Zn(2+) (do reakcii zaryad +9. a posle zaryad tozhe dolzhen byt’ +9. no u nas +3.)
4Zn + 10H(+) + NO3(-) -> NH4(+) + 3H2O + 4 Zn(2+) (Poetomu umnozhem Zn na 4 v oboix sotoronax.)
4Zn + 10H(+) + 10NO3(-) -> NH4(+) + 3H2O + 4Zn(2+) + 9NO3(-)
4Zn + 10 HNO3 -> NH4NO3 + 4Zn(NO3)2 + 3H20
Соли аммония. Общая характеристика. Химические свойства.
Соли аммония.
Аммоний, NH 4 + это положительно — заряженный многоатомный ион, который образуется при протонировании (перенос протона от кислоты к основанию) аммиака (NH3) .
Ион аммония образуется, когда аммиак, слабое основание, реагирует с кислотами Бренстеда (доноры протонов):
Однако, будучи слабокислым, реагирует с основаниями Бренстеда , возвращаясь к незаряженной молекуле аммиака:
Таким образом, обработка концентрированных растворов солей аммония сильным основанием дает аммиак.
Когда аммиак растворяется в воде, его небольшое количество превращается в ионы аммония:
- Степень, до которой аммиак образует ион аммония, зависит от рН раствора:
— если pH низкий, равновесие смещается вправо: больше молекул аммиака превращается в ионы аммония.
— если pH высокий, равновесие сдвигается влево: ион гидроксида отнимает протон от иона аммония, образуя аммиак.
Важно! Все соли аммония растворимы в воде, кроме гексахлороплатината аммония (раньше использовалось в качестве теста на NH4 + )
Наибольшее значение среди солей аммония в промышленности имеют хлорид аммония (NH4Cl), сульфат аммония ((NH4)2SO4), нитрат аммония (NH4NO3), характеристики которых мы сегодня и пройдем.
Хлорид аммония, NH4Cl (аммиачная соль) — белое кристаллическое твердое вещество. хорошо растворим в воде (37%), образует слегка кислый раствор ; испаряется без плавления при 340 ° C с образованием равных объемов аммиака и хлористого водорода.
Уровень опасности: раздражающее средство
- Его основное применение — подача азота в удобрениях и в качестве электролита в сухих элементах
- Также широко используется в качестве компонента флюсов для цинкования, лужения и пайки для удаления оксидных покрытий с металлов и, тем самым, улучшения адгезии припоев.
- Он является компонентом многих патентованных лекарств от простуды и средств от кашля благодаря своей эффективности в качестве отхаркивающего средства,
- В ветеринарной медицине его используют для профилактики мочекаменной болезни у коз, крупного рогатого скота и овец.
3) С щелочами (Ме АІ):
4) С щелочами (Ме АІІ):
5) С нерастворимыми основаниями:
6) C основаниями (комплексообразующими):
8) С солями летучих кислот:
9) С оксидами малоактивных Ме:
10) С оксидами активных Ме:
Сульфат аммония (диаммониевая соль серной кислоты) — белое, твердое вещество, без запаха, хорошо растворяется в воде (103,8 гр в 100 гр воды при 100° С), легко впитывает воду (если подвергается воздействию влажного воздуха, образует «струпья» на влажных поверхностях ); температура плавления — выше 280° С; используется в процессе фракционирования (разделения) белков.
Уровень опасности: окислитель, раздражающее средство, экологически опасен
- Сульфат аммония широко распространен в качестве пищевой добавки E517 (регулятор кислотности в хлебе), благодаря активации дрожжей
- (NH4)2SO4 используется в качестве удобрения для щелочных почв ( при внесении во влажную почву выделяется NH 4 + , что создает небольшое количество кислоты, которая снижает рН баланс почвы, а также способствует выделению азота, который помогает росту растений)
- Наконец, он играет важную роль в разработке вакцин во время процесса очистки. Вакцина DTap , которая защищает детей от дифтерии, столбняка и коклюша, использует для этой цели сульфат аммония.
Нитрат аммония, NH4NO3 (аммиачная селитра, аммониевая соль азотной кислоты ) — бесцветное кристаллическое вещество (температура плавления 169,6 ° C); хорошо растворим в воде.
Уровень опасности: окислитель (взрывчатое вещество), раздражающее вещество
- Нагревание водного раствора разлагает соль до закиси азота (веселящий газ):
Поскольку твердая аммиачная селитра может подвергаться взрывному разложению при нагревании в замкнутом пространстве, на ее транспортировку и хранение были наложены государственные стандарты.
- Товарный сорт содержит около 33,5% азота, причем все они находятся в формах, пригодных для использования растениями; это наиболее распространенный азотный компонент искусственных удобрений.
- Аммиачная селитра также используется для изменения скорости детонации других взрывчатых веществ, таких как нитроглицерин (в так называемых аммиачных динамитах ), или в качестве окислителя в аммоналах , которые представляют собой смеси нитрата аммония и порошкообразного алюминия.
- Применяется в качестве питательного вещества при производстве антибиотиков и дрожжей.
NH4NO 3
http://sprashivalka.com/tqa/q/27958539
http://pangenes.ru/post/soli-ammoniya-obshchaya-harakteristika-himicheskie-svoystva.html