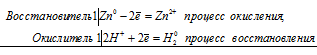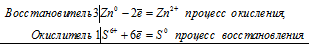Zn oh 2 na2so4 ионное уравнение
Вопрос по химии:
Помогите пожалуйста.
Написать молекулярное, полное и краткое ионное уравнение химической реакции: гидроксид натрия и сульфат цинка
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
2naoh + znso4 = zn(oh)2 + na2so4
2na+() + 2oh(-) + zn(2+) + so4(2-) = zn(oh)2 + 2 na(+) + so4(2-)
2oh(-) + zn(2+) + so4(2-) = zn(oh)2 + so4(2-)
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Электронные и молекулярные уравнения реакций цинка и кадмия
Задание 393
Составьте электронные и молекулярные уравнения реакций цинка: а) с раствором гидроксида натрия; б) с концентрированной серной кислотой, учитывая восстановление серы до нулевой степени окисления.
Решение:
Уравнения реакций цинка
а) с раствором гидроксида натрия
Zn 0 + 2H + = Zn 2+ + H2 0
б) с концентрированной серной кислотой
3Zn 0 + S 6+ = 3Zn 2+ + S 0
Задание: 396
Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Cd → Cd(NO3)2 → Cd(OH)2→ [Cd(NH3)6](OH)2→ CdSO4
Решение:
Уравнения реакций, которые надо провести для осуществления следующих превращений:
будут иметь вид:
Задание 398
К какому классу соединений относятся вещества, полученные при действии избытка гидроксида натрия на растворы ZnCl2, CdCl2, HgCl2? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
Решение:
При действии на растворы ZnCl2 и CdCl2 избытка гидроксида натрия сначала образуются соответственно нерастворимые Zn(OH)2 и Cd(OH):
Осадок гидроксида цинка как амфотерное основание растворяется в избытке гидроксида натрия с образованием комплексного иона [Zn(OH)4] 2- :
Гидроксид кадмия в отличие от гидроксида цинка не обладает ярко выраженными амфотерными свойствами, поэтому в избытке гидроксида натрия не растворяется.
При действии щелочей на растворы солей Hg 2+ выделяется высокодисперсный жёлтый осадок HgO:
Задание 403
На гидроксиды цинка и кадмия подействовали избытком растворов серной кислоты, гидроксида натрия и аммиака. Какие соединения цинка и кадмия образуются в каждой из этих реакций? Составьте молекулярные и ионно-молекулярные уравнения ре-акций?
Решение:
Гидроксиды цинка и кадмия амфотерные соединения, только амфотерные свойства у Cd(OH)2 выражены слабее, чем у Zn(OH)2.
а) При действии кислот на Cd(OH)2 и Zn(OH)2 образуются соответствующие соли:
б) При действии сильного основания на Zn(OH)2 образуется комплексная соль Na2[Zn(OH)4]:
Амфотерные свойства у Cd(OH)2 выражены гораздо слабее, чем у Zn(OH)2, поэтому гидроксид кадмия в избытке щёлочи не растворяется, но при длительном кипячении в растворе щёлочи гидроксид кадмия растворяется с образованием гексагидроксокадмиат(II)-ионы [Сd(OH)6] 4- :
в) При действии избытком раствора аммиака на гидроксиды цинка и кадмия образуются комплексные соединения:
Гидролиз сульфата цинка
ZnSO4 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Zn 2+ + 2SO4 2- + 2HOH ⇄ 2ZnOH + + SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Zn 2+ + HOH ⇄ ZnOH + + H +
Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2ZnOH + + SO4 2- + 2HOH ⇄ 2Zn(OH)2 + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
ZnOH + + HOH ⇄ Zn(OH)2 + H +
Среда и pH раствора сульфата цинка
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
http://buzani.ru/zadachi/khimiya-shimanovich/989-tsink-i-kadmij-zadaniya-393-396-398-403
http://chemer.ru/services/hydrolysis/salts/ZnSO4