ОCНОВНЫЕ ПОНЯТИЯ. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. ЗАКОНЫ ФАРАДЕЯ.
Одним из важнейших элементов внутренней цепи является граница раздела электрод-ионный проводник. На этой границе возникает так называемый двойной электрический слой, характеризуемый сложным взаимодействием металла с компонентами раствора, которое приводит к скачку потенциала, который называют электродным потенциалом. Величина этого скачка потенциала зависит от природы электрода, состава электролита и температуры. Абсолютное значение электродного потенциала определить нельзя, но можно измерить разность потенциалов между двумя электродами. Такой электродный потенциал принято обозначать 
Ox + n 

Электродный потенциал в отсутствии тока в цепи при равновесии потенциалопределяющей реакции называется равновесным и обозначается 




В электрохимии общепринятой является водородная шкала потенциалов, в которой за нуль принят потенциал стандартного водородного электрода при 298 К; 


Потенциалопределяющей на таком электроде является реакция
2H + (p) + 2 

Значения стандартных потенциалов электродов в водных растворах при 298 К, определенные по водородной шкале представлены в таблице 1 Приложения.
Значения равновесных потенциалов для условий, отличительных от стандартных, рассчитывают по уравнению Нернста, которое в общем случае для потенциалопределяющей реакции (1.1) имеет вид:

где – R – универсальная газовая постоянная, 8,31Дж/моль . К; n – число электронов, принимающих участие в реакции (равно числу моль эквивалентов в моль вещества); F – число Фарадея, 96500 Кл/моль-экв (26,8А . ч/моль-экв); T – температура, К.
Существует 3 различных типов электродов: 1) металлические (металлы в растворе собственных ионов); 2) газовые (на основе Pt в растворе электролита, через который пропускает соответствующий газ); 3) окислительно-восстановительные (инертный электрод в растворе, содержащей окисленную и восстановленную формы в ионном виде – редокс-электроды).
Для металлических электродов потенциалопределяющей является реакция :
M(р) n + + n 

Уравнение Нернста для расчета потенциала металлического электрода, поскольку активность твердой фазы принимают равной единице, имеет вид:

Для 298 К, переходя к десятичному логарифму, имеем

Для водородного электрода потенциалопределяющая реакция (1.2), уравнение Нернста запишем в виде:

Поскольку, как указано выше, 


Газовый кислородный электрод представляет собой Pt – электрод, на котором осуществляется потенциалопределяющая реакция
О2 + 4 

Уравнение Нернста для такого электрода запишется в виде:

Стандартный потенциал кислородного электрода 





Законы Фарадея. Количественно электрохимические превращения веществ подчиняются двум законам Фарадея:
1) масса или количество вещества, претерпевшего превращение на электроде при протекании постоянного тока, прямо пропорционально количеству прошедшего электричества;
2) при прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в электродных реакциях, пропорциональны молярным массам их эквивалентов. Из этого следует, что для электрохимического превращения 1 моль эквивалента вещества требуется одинаковое количество электричества F, называемое числом Фарадея.
Оба эти закона можно объединить следующими выражениями:
— для массы вещества: 
— для объема газообразных веществ: 
где МЭ – молярнаямасса эквивалента вещества, г/моль, 
VЭ – объем моль-эквивалента газа, л/моль; 
Q – количество электричества, прошедшего через систему, Кл,

( При нормальных условиях (н.у.) 1 моль любого газа занимает объем



Количество моль-эквивалентов веществ, испытавших электрохимические превращения на катоде и аноде, выраженные в моль-эквивалентах, равны между собой
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Гальваническим элементом (ГЭ) называется электрохимическая система, в которой химическая энергия превращается в электрическую.
Рис. 1.1. Схема гальванического элемента
Представленный на рисунке 1.1. ГЭ состоит из двух электродов 1 (катода К и анода А), погруженных в растворы собственных солей (2) и разделенных диафрагмой (3) проницаемой для ионов. Электроды через внешнюю цепь (4) соединены между собой металлическими проводниками.
При разомкнутой цепи в ГЭ на обоих электродах устанавливается равновесие, характеризуемое величиной соответствующих равновесных электродных потенциалов (ЭП). Разность равновесных ЭП катода и анода называется электродвижущей силой ГЭ:

Разность стандартных ЭПназывается стандартной ЭДС ГЭ:


При замыкании цепи равновесие нарушается, во внешней цепи возникает самопроизвольное направленное движение электронов от анода – электрода с меньшим потенциалом, к катоду – электроду с большим потенциалом.
Электродные реакции, например, для серебряно-цинкового элемента записываются следующим образом:


Суммируя анодную и катодную реакции, получаем уравнение токообразующей реакции (ТОР):
Zn + 2Ag + → 2Ag + Zn 2+ , (2.3).
Электродвижущая сила элемента связана с энергией Гиббса ТОР 

где п — количество моль-эквивалентов вещества.
В общем случае, для ТОР реакции:
bB + dD → lL + mM, (2.5),
протекающей в ГЭ при стандартных состояниях веществ при Т = 298 К, энергия Гиббса 

Таким образом стандартную ЭДС ГЭ можно определить двумя способами:
— первый способ по уравнению 
— второй способ по уравнению (2.1а), используя табличные значения стандартных потенциалов.
ЭДС гальванического элемента для ТОР при активности ионов отличных от 1 моль/л можно рассчитать из выражения:

где аВ, аD, аL , aM, – активности веществ; b, d, l, m – стехиометрические коэффициенты ТОР (2.5). Для твердых веществ активности принимают равными единице.
Максимальная электрическая работа ГЭ определяется соотношением 

В работающем ГЭ при прохождении тока I напряжение U меньше ЭДС из-за явления поляризации катода (DEК) и анода (DЕА) и омического падения напряжения на сопротивлении r1 в проводниках с электронной проводимостью (проводниках первого рода) и на сопротивлении r2 в электролите (проводнике второго рода)

Поляризацией называется изменение потенциала электрода при прохождении электрического тока: 
Зависимость потенциала электрода от тока графически изображается поляризационной кривой. В гальваническом элементе при прохождении электрического тока потенциал анода становится более положительным, а потенциал катода – более отрицательным, что приводит к уменьшению напряжения U. Поляризационные кривые ГЭ представлены на рисунке 1.2.
Рис. 1.2. Поляризационные кривые ГЭ.
Пример 1.1.Рассмотрите работу серебряно-цинкового гальванического элемента. Напишите катодные и анодные процессы, рассчитайте стандартную ЭДС элемента при 298 К двумя способами.
Решение.Выпишем из таблицы 1 приложения значения стандартных электродных потенциалов Zn и Ag:


Т.к. 
1 способ: рассчитаем 

2 способ: по уравнению (2.6) рассчитываем

По уравнению 2.4 : 
Значения 
Пример 1.2.Рассчитать ЭДС серебряно – цинкового ГЭ при Т = 298 К, если активность Zn 2+ и Ag + равны по 0,01 моль/л.
Решение. Процессы, протекающие в ГЭ, и стандартная ЭДС элемента те же, что в примере 1.1. Рассчитаем величины электродных потенциалов.
Равновесные потенциалы электродов рассчитываем по уравнению Нернста для металлических электродов (уравнение 1.4 а):



При одинаковой активности потенциалопределяющих ионов в данном ГЭ согласно уравнению Нернста, изменение анодного потенциала больше, чем катодного, ЭДС элемента меньше, чем стандартная ЭДС.
Пример 1.3.Рассчитайте величину максимальной электроэнергии, которая может быть выработана серебряно – цинковым ГЭ при уменьшении массы анода на 1 г в результате протекания электрохимической реакции при условиях заданных в примере 1.2.
Решение. Анодом ГЭ является цинковый электрод. Количество электричества Q, прошедшего через электродную поверхность, рассчитывается из объединенного закона Фарадея:
Максимально вырабатываемая электроэнергия 
Пример 1.4.Рассчитайте ЭДС цинк-хлорного ГЭ, если 


Решение.
Рассчитаем значения равновесных электродных потенциалов для соответствующих электродов по уравнению Нернста.
Для потенциалопределяющей реакции Zn 2+ + 2 


Для потенциалопределяющей реакции Cl2(газ) + 2 


Так как 

А — : Zn – 2 
К + : Cl2 + 2 
ТОР: Zn + Cl2 → Zn 2+ + 2Cl –
Вычислим значения ЭДС ГЭ: 
Увеличить ЭДС данного ГЭ можно, если: увеличить температуру; уменьшить активность ионов Zn 2+ ; уменьшить активность ионов Cl – ; увеличить парциальное давление Cl2 .
Пример 1.5. Рассчитайте ЭДС щелочноговодородно-кислородного ГЭ, работающего при одинаковых давлениях 

Решение.Для кислой среды уравнения электродных реакций в концентрационном элементе:
А — : H2 +2ОН — → 2Н2О + 2
К + : 1/2О2 + 2 

Величина равновесного потенциала этих электродов определяется по уравнению:



Для кислотноговодородно-кислородного топливного элемента:
на аноде: H2 — 2 
на катоде: 1/2О2 + 2H + + 2 


Электролизом называются электрохимические процессы прямого (непосредственного) преобразования электрической энергии в химическую, протекающие на электродах под действием постоянного тока. Под действием электрического поля беспорядочное движение ионов в электролите превращается в направленное: положительно заряженные ионы (катионы) перемещаются к отрицательному электроду – катоду, отрицательно заряженные ионы (анионы) движутся к положительному электроду – аноду.
При электролизе катод подсоединяется к отрицательному полюсу внешнего источника тока, а анод – к положительному. На катоде ( К – ) происходят процессы восстановления: положительные ионы или нейтральные молекулы принимают электроны и переходят в восстановленную форму. На катоде в первую очередь идут процессы, характеризующиеся более положительным потенциалом, т.е. восстанавливаются более сильные окислители. На аноде (А + ) могут окисляться анионы, нейтральные молекулы и сам материал анода. Анод может быть растворимым, т.е. окисляться в условиях электролиза, и инертным, нерастворимым, т.е. не участвовать в анодном процессе. К растворимым или частично растворимым анодам относятся Zn, Cu, Fe, Cd, Ag, Ni, Co и т.д., к нерастворимым – Pt, Pd и некоторые другие благородные металлы в определенных условиях, а также графит С. На аноде в первую очередь окисляются более сильные восстановители, т.е. идут процессы, характеризующиеся более отрицательным потенциалом.
Для того, чтобы правильно определить процессы электролиза, необходимо рассмотреть ионный состав электролита и определить равновесные потенциалы возможных процессов. Для расчета равновесных потенциалов возможных процессов, используется уравнение Нернста. Если не указаны конкретные условия, то для оценочной характеристики процессов используются стандартные потенциалы материала анода 





При относительно малом отличии равновесных потенциалов (менее 0,8 ¸ 1,0 В) на электродах возможно параллельное протекание нескольких процессов. Если на электроде идут одновременно несколько процессов, то доля количества электричества, пошедшего на каждый из процессов, называется выходом по току (Вj ):

где Qj – количество электричества, пошедшее на конкретный процесс;
Q – общее количество электричества, прошедшее через электрохимическую систему.
Сложные кислородсодержащие ионы, такие как SO4 2- , NO3 — , PO4 3- и др. из водных растворов на аноде не окисляются, т.к. обладают существенно более положительным потенциалом разряда, чем гидроксид-ион OH – .
Ионы элементов (приложение 1, табл. 1), обладающие высоко отрицательным электродным потенциалом (Al 3+ , Na + и др.) из водных растворов на катоде не восстанавливаются. Их разряд на катоде возможен только из расплавов соответствующих солей или из неводных растворов.
Количество вещества, испытавшего электрохимические превращения на электродах, рассчитывается по закону Фарадея.
При электролизе в результате прохождения через систему постоянного электрического тока происходит поляризация электродов (DЕК, DЕА): потенциал анода становится более положительным, а потенциал катода – более отрицательным и возникает омическое падение напряжения на внутреннем сопротивлении электрохимической цепи R (DЕом = R . I). Поэтому напряжение ( U ), которое необходимо подать на электроды от внешнего источника постоянного тока, больше минимальной разности потенциалов (Umin), равной разности равновесных потенциалов процессов :

Ход поляризационных кривых при электролизе показан на рис. 3.1. :
|
|
Рис. 3.1. Поляризационные кривые при электролизе.
Пример 3.1. Рассмотрите электролиз расплава соли хлорида лития LiCl на нерастворимых Pt-электродах. Рассчитайте минимальную разность потенциалов Umin электролиза. Напишите уравнения электродных процессов.
Решение. Запишем ионный состав электролита:
и стандартные потенциалы электродных процессов:
К — : 
A + : 

K — : Li + + 
A + : 2Cl — → Cl2 + 2 
Данный электролиз можно использовать для получения лития и хлора.
Пример 3.2. Определите минимальную разность потенциалов Umin , которую необходимо подать на Pt-электроды для проведения электролиза водного раствора KOH, рН = 12. Напишите уравнения процессов электролиза. Рассчитайте объемы газов (приведенные к нормальным условиям), которые образуются на электродах за 10 часов при токе 5А.
Решение. Запишем уравнения диссоциации раствора электролита
КОН → К + + ОН — ; H2O 
и определим равновесные потенциалы возможных электродных процессов:
К — : 

А + : 
Так как Е 0 К + /К значительно отрицательнее 
Минимальная разность потенциалов для электролиза данного раствора:

Объем газов, выделившихся на электродах, рассчитаем по закону Фарадея (условия нормальные):


Электролиз водного раствора гидроксида калия широко применяется для электрохимического получения водорода.
Пример 3.3. Рассмотрите электролиз водного раствора CuCl2 на графитовых (нерастворимых) электродах. Напишите электродные процессы, покажите ход поляризационных кривых. Рассчитайте массу меди, образовавшейся на катоде, если за это же время на аноде выделилось 5,6 мл Cl2 и 5,6 мл O2 .
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
H2O 
Соль CuCl2 образована слабым основанием Cu(OH)2 и сильной кислотой HCl, следовательно, при ее растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н + , раствор электролита будет иметь слабокислую реакцию среды (примем рН = 5).
Определим потенциалы возможных процессов на аноде и катоде и запишем уравнения электродных процессов:
К — : 

т.к. 

A + : 

т.к. 

K — : Cu 2+ + 2 
A + : 2H2O → O2 + 4H + + 4
2Cl — → Cl2 + 2 
Электролиз данного раствора можно проводить для нанесения медного покрытия на изделие, а также для получения газообразных кислорода и хлора.
 |
Рис. 3.2. Поляризационные кривые процесса электролиза водного раствора хлорида меди на нерастворимых электродах.
Определим массу меди, образовавшейся на катоде, для чего сначала рассчитаем объемы моль эквивалентов газов при н.у. и массу моля эквивалента меди:



По закону Фарадея определим количество электричества, необходимое для выделения заданных объемов кислорода и хлора на аноде (н.у.):


Суммарное количество электричества, прошедшее через анод, равно:

Такое же количество электричества на катоде (QК = QА) пойдет только на один процесс образования меди. По закону Фарадея определим массу выделившейся меди:

Определим выход по току (Bj) для всех процессов электролиза:



Пример 3.4. Рассмотрите электролиз водного раствора CuCl2 на медных электродах. Напишите уравнения электродных процессов, покажите ход поляризационных кривых. Чем отличается ход поляризационных кривых в данном варианте от варианта, рассмотренного в примере 3.3.?
Решение. Ионный состав раствора электролита таков же, как в примере 3.3., поэтому на катоде, как и в случае с электролизом на нерастворимых электродах, пойдет только процесс восстановления ионов меди.
Потенциалы возможных процессов на аноде:





K — : Cu 2+ + 2 
A + : Cu → Cu 2+ + 2 
При больших напряжениях электролизера U , могут быть достигнуты 


Благодаря растворению под действием тока медного анода запас ионов Cu 2+ в растворе электролита будет восполняться, и процесс образования медного покрытия на катоде будет идти более интенсивно, чем в случае использования инертных электродов (пр. 3.3.).
Рис. 3.3. Поляризационные кривые процесса электролиза водного раствора хлорида меди на медных электродах.
Пример 3.5. Рассмотрите электролиз водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах. Напишите уравнения электродных процессов. Рассчитайте выход по току веществ, если на катоде одновременно образовалось 30г Sn, 52г Pb и 2,8л Н2 (условия нормальные).
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
H2O 
Соли Sn(NO3)2 и Pb(NO3)2 образованы слабыми основаниями и сильной кислотой, следовательно, при их растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н + , раствор электролита будет иметь слабокислую реакцию среды (примем рН ≈ 5).
Определим равновесные потенциалы возможных процессов на аноде и катоде:
К — : 


т.к. 


Таким образом, на электродах протекают следующие процессы:
K — : Pb 2+ + 2e → Pb
A + : H2O → O2 + 4H + + 4 
Запишем массы и объем (при нормальных условиях) моль эквивалентов веществ, образовавшихся на катоде:



По закону Фарадея определим количество электричества, необходимое для получения на катоде заданного количества вещества (н.у.):



Суммарное количество электричества, прошедшее через катод:

Определим выход по току (Bj) для всех процессов электролиза:





Рис. 3.4. Поляризационные кривые процесса электролиза водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах.
Пример 3.6. Рассмотрите процесс рафинирования никеля, содержащего примеси цинка и меди в водном растворе H2SO4. Какие процессы будут протекать на аноде и катоде? Какое время нужно для проведения рафинирования при токе 500 А для выделения 5 кг никеля при выходе по току 98%?
Решение. Рафинирование – очистка металла от примесей с помощью электролиза. На аноде растворяются основной металл и примеси, потенциал которых отрицательнее основного металла. Примеси, имеющие более положительный потенциал, не растворяются и выпадают из анода в виде шлама. На катоде в первую очередь выделяется металл, имеющий наиболее положительный потенциал.
Анод – очищаемый металл Ni с примесями Zn и Cu. Ионный состав раствора электролита: H + , SO4 2- , OH — . Запишем равновесные потенциалы возможных электродных процессов при рН = 2:





Так как 

Запишем уравнения электродных процессов:
А + : Zn → Zn 2+ + 2e
K — : 2H + + 2e → H2
Время, необходимое для рафинирования, рассчитаем по закону Фарадея ( 

4. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
Коррозией называют самопроизвольное разрушение металлических материалов под действием компонентов окружающей среды. В результате коррозии протекает суммарная окислительно-восстановительная реакция взаимодействия металла с окислителем:
При этом происходит окисление металла и разрушение металлоконструкций.
Для металла именно окисленное состояние является те
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ.
Пример 1. Вычислить электродный потенциал цинка, опущенного в раствор его соли с концентрацией ионов 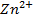
Решение. Для количественной характеристики активности металлов используется разность потенциалов в гальваническом элементе, образованном электродом, содержащим металл, и стандартным водородным электродом, потенциал которого принят равным нулю.
Если активность α или концентрация 
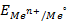
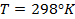
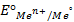
где 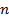
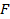
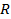
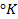
при 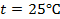
Таким образом, рассчитать требуемый электродный потенциал можно, используя уравнение
Отыскав по таблице значение нормального цинкового потенциала
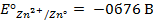
Пример 2. Вычислить потенциал серебряного электрода в насыщенном растворе
(ПР = 6 ∙ 10 -13 ), содержащем, кроме того, 0,1 моль/л бромида калия.
Решение. Уравнение Нернста для вычисления требуемого электродного потенциала имеет вид
где
Необходимое для расчёта значение величины концентрации ионов серебра 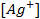
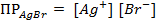
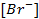
Подставляя полученное значение 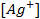
Пример 3. Вычислить ЭДС цепи
Написать протекающие электродные процессы (Коэффициенты активности ионов серебра и цинка соответственно равны 0,79 и 0,52; температура опыта 25 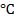
Решение. ЭДС ( 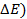
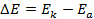
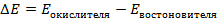
Зная, что активность является вспомогательной расчётной величиной, которая характеризует отклонение свойств вещества в данной фазе (в рассматриваемом случае жидкости) от свойств его в состоянии, принимаемом за стандартное (идеальные растворы), величины активности ионов входящих в состав данного гальванического элемента, можно определить по формуле, связывающей активность иона с его концентрацией:
где 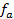
Подставив соответствующие величины, получим:
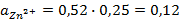
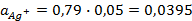
Электродные потенциалы серебра и цинка вычисляем по формуле Нернста:
где 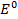
a – активность ионов; n – заряд иона.
Работу гальванического элемента определяют реакции
анодная (А): катодная (К):
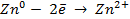
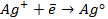
так как известно, что в данной паре металлов цинковый электрод будет заряжен отрицательно и будет анодом в силу его положения в ряду напряжений металлов.
Пример 4. Элемент составлен из нормальных водородного и кислотного электродов. Изменится ли его ЭДС, если давление газов (водорода и кислорода) увеличить в 10 раз?
Решение. Запишем схему элемента и электродные реакции:
Зная, что величины электродных потенциалов для водородного и кислородного электродов соответственно равны
заменяем величины концентрации свободных водорода и кислорода на величины их парциальных давлений и получаем выражения уравнения Нернста для этих электродов в следующем виде в расчёте на 1 
для водородного электрода
для кислородного электрода
Соответственно ЭДС ( 
Под величиной 
При
При
Следовательно, увеличение давления кислорода и водорода в 10 раз приводит к увеличению 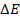
Пример 5. Найти потенциал водородного электрода при 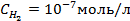
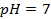
Решение. При Р = 1 атм., электродный потенциал водородного электрода равен
где
Пример 6. Напишите общую химическую реакцию, определяющую работу гальванического элемента
его электродные реакции и определите его ЭДС.
Решение. Известно (из таблиц), что 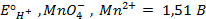
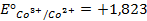
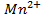
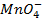
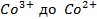
 |
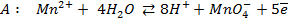
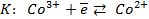
Зная, что электродный потенциал окислительно- восстановительного электрода вычисляется по уравнению Нернста
или для Т = 298 К
Для данных электродов эти уравнения имеют вид
Пример 7. Какие процессы происходят на электродах гальванического элемента
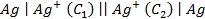
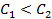
Решение. Известно, что гальванические элементы, работа которых обусловлена лишь различием концентрации электролита в разных зонах раствора при одинаковом составе электродов, носят название концентрационных. Более отрицательным электродом в этом случае считается тот, который опущен в раствор с меньшей концентрацией.
Следовательно, в предлагаемом элементе серебряный электрод, погруженный в менее концентрированный раствор, будет заряжен более отрицательно, т.е. он будет анодом. Электродная реакция 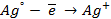
На электроде, заряженном менее отрицательно, который будет являться катодом, идёт реакция восстановления ионов серебра:
При этом электроны будут перемещаться от анода к катоду, а ток, получаемый в результате работы этого элемента, пойдёт в противоположном направлении.
Пример 1. Что такое электролиз? Какие законы электролиза Вы знаете? Какие количественные законы электролиза Вы знаете?
Решение. Электролизом называется окислительно- восстановительный процесс, происходящий в растворе или расплаве электролита при пропускании через него электрического тока.
Электрод, соединенный с отрицательным полюсом источника тока, называется катодом (-); электрод, соединенный с положительным источником тока, называется анодом (+).
Схему электролиза в общем виде можно представить следующим образом:
| катионы движутся к катоду (т.е. отрицательно заряженному электроду), где происходит процесс восстановления молекул или положительно заряженного иона | анионы движутся к аноду (т.е. положительно заряженному электроду), где происходит процесс окисления молекул или отрицательно заряженного иона |
Для проведения электролиза могут использоваться растворимые или нерастворимые аноды. Последние сами не участвуют в окислительно- восстановительной реакции, а являются только передатчиками электронов. В качестве нерастворимых анодов используют платину и другие благородные металлы, графит. Растворимые металлические аноды при проведении электролиза разрушаются.
Основные законы электролиза установил М. Фарадей.
1-й закон. Количество вещества, образующегося при электролизе, прямо пропорционально количеству прошедшего электричества:
где m – количество вещества в граммах, Q – Количество электричества в кулонах Q = Jt , где
J – сила тока, А; t – время, с; К – коэффициент пропорциональности.
2-й закон. При пропускании равного количества электричества в результате электролиза выделяются количества веществ m, пропорциональные их химическим эквивалентам Э. Для выделения 1 г – экв. требуется количество электричества, равное числу Фарадея F = 96487 кулонов, т.е.
Математически, обобщив законы Фарадея, получим:
Пример 2. Какие процессы протекают при электролизе расплавов солей 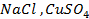
Решение. Установим, на какие ионы диссоциируют перечисленные соединения:
Представим протекание процесса электролиза каждого из веществ.
При пропускании через расплав 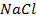
электронейтрального натрия: (К): 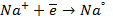
Отрицательно же заряженные ионы хлора притягиваются к положительно заряженному электроду А, где они разряжаются до свободного хлора, отдавая свой электрон: (А):
Аналогично разобранному примеру можно представить схемы электролиза 
 |  |
| (-) катод | (+) анод |
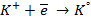 | 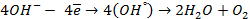 |
 |  |
| (-) катод | (+) анод |
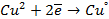 | 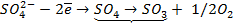 |
Пример 3. Как влияет положение металла в ряду напряжений и состав кислотного остатка на процессы электролиза растворов солей?
Решение. В растворах солей металлов, кроме ионов металла и ионов кислотного остатка, присутствуют 
Наличие кислородсодержащих анионов приводит к окислению 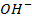
который требует значительного большего сдвига потенциала в положительную сторону. Поэтому в обычных условиях окисления кислородсодержащих кислотных остатков, таких как 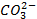
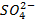
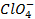
Бескислородные же анионы окисляются легче до свободного состояния, чем 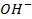
| А: | 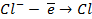 2 2 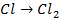 | или | 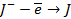 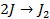 |
Поведение металла при электролизе четко определено его положением в ряду напряжений. Чем левее расположен он в ряду, тем больший сдвиг потенциала в отрицательную сторону необходим для его восстановления до свободного состояния. Поэтому легче всего восстанавливаются ионы металлов, характеризующиеся наиболее электроположительной величиной потенциала (т.е. расположенные в крайней правой части ряда (после водорода): 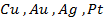
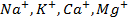
При электролизе же металлов, расположенных в средней части ряда (от алюминия до водорода), имеющих потенциал разложения, сравнимый с величиной потенциала разложения воды, протекает реакция как восстановления самого металла, так и молекул воды, т.е. с выделением в чистом виде металла и газообразного водорода.
Обобщив все вышеперечисленное, можно сделать вывод, что при проведении электролиза будут восстанавливаться положительные ионы, требующие наименьшего сдвига потенциала в отрицательную сторону, т.е. вероятность выделения металла в чистом виде уменьшается при переходе в ряду напряжений справа налево (от Au к Na). Что качается смеси анионов, то в этом случае необходимо учитывать наличие кислорода в кислотном остатке и способность бескислородных ионов к окислению.
Практически установлено, что вероятность их выделения в чистом виде уменьшается по следующему ряду:
В качестве примеров можно привести схемы электролиза нескольких характерных солей (аноды инертные):
а) электролиз раствора
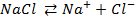
| (+) на аноде | (-) на катоде |
2 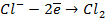 | 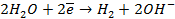 |
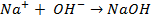
б) электролиз
диссоциация:
| катод (-) | анод (+) |
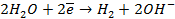 | 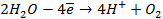 |
в) электролиз раствора
диссоциация:
| катод (-) | анод (+) |
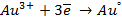 | 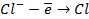 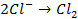 |
(Потенциал разложения 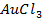
Анод растворимый (например, никелевый)
а) электролиз раствора
диссоциация:
| катод (-) | анод (+) |
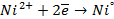 | 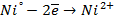 |
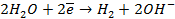 | 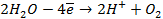 |
При использовании растворимых анодов в окислительно- восстановительную реакцию вступает металл анода и происходит его окисление (т.е. он растворяется). Это вызвано тем, что металл выбранного растворимого анода имеет потенциал окисления значительно ниже, чем требуется для окисления аниона и даже ниже потенциала разложения воды.
3.3. КОРРОЗИЯ МЕТАЛЛОВ.
Пример 1. а) Объясните, почему луженое железное изделие (например кастрюля) при нарушении защитного слоя корродирует быстрее, чем оцинкованное железное изделие (например ведро)?
Решение. Как луженое, так и оцинкованное изделие подвергают электрохимической коррозии. Природу протекающих процессов можно объяснить, используя величины окислительно- восстановительных (электродных) потенциалов металлов, находящихся в контакте друг с другом и электролитом. Известно, что
Про контакте железа с оловом и нарушении целостности луженого покрытия в среде электролита возникают коррозионные микрогальванопары, работа которых определяет разрешение основного металла – железа. Связано это с тем, что железо обладает более электроотрицательным электродным потенциалом по сравнению с оловом. Таким образом, в паре Fe – Sn олово, как менее электроотрицательный металл, будет катодом, т.е. только переносчиком электронов, которые возникают при окислении основного металла железа, являющегося в данном случае анодом (А)
На катоде в зависимости от условий при этом может протекать один из процессов:
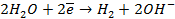
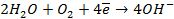
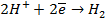
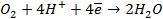
Нарушение же циклового покрытия при контакте его с железом не приводит к разрушению основного металла (железа), так как в этом случае будет разрушаться цинковое покрытие (электродный потенциал цинка более электроотрицателен по сравнению с электродным потенциалом железа), т.е. цинк будет анодом 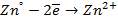
Пример 2. Почему железо, частично покрытое хромом, корродирует, хотя хром имеет более отрицательный стандартный потенциал, чем железо? Стандартные потенциалы хрома и железа соответственно равны -0,74 и -0,44 В.
Решение. По месту, занимаемому хромом в ряду напряжений, следовательно бы ожидать, что хром в паре с железом будет работать как анодного покрытие, т.е. разрушаться, предотвращая коррозию железа. Однако этого не происходит из-за присутствия на поверхности хрома прочной оксидной пленки, которая в корне меняет взаимоотношения металлов.
Можно предположить, что образование адсорбционной плёнки, пассивирующей металл, приводит как бы к созданию на поверхности хрома кислородного электрода, потенциал которого, как известно равен +0,401 В, т.е. пассивное состояние поверхности хрома выражается в значительном смещении электродного потенциала металла в положительную сторону, по сравнению с величиной потенциала железа, что и не позволяет хрому быть анодным покрытием железа.
Пример 3. Как влияет 
Решение. Течение коррозийных процессов всегда зависит от концепции ионов Н + , способствует разрядке их на катоде, и этим облегчается катодная деполяризация и растворение металла с анодных участков. Например, это способствует усилению коррозии черных металлов. При значительном повышении концентрации Н + процесс может перейти в обычное растворение металла в кислоте. Коррозия 
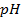
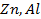
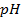
1. При 25 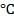
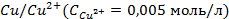
2. Рассчитать электродный потенциал цинка, погружённого в раствор, содержащий ионы 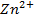
3. Найти потенциал водородного электрода при 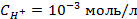
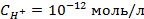
4. Найти потенциал водородного электрода в щелочной среде при 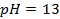
5. Как должна быть составлена гальваническая цепь для того, чтобы осуществлять электрохимическим путём следующие реакции:
а)
б)
в)
г)
д) 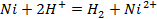
Для каждого случая указать:
а) электрод- восстановитель и электрод- окислитель,
б) знаки полюсов,
в) направление перемещения электронов во внешней цепи.
6. Составить схемы двух гальванических элементов, в одном из которых никель – отрицательный электрод, в другом – положительный.
7. Какие реакции протекают у электродов в гальванических элементах, образованных:
а) железом и оловом, погруженными в растворы своих солей,
б) оловом и медью, погружёнными в растворы своих солей?
8. Рассчитайте ЭДС газового элемента 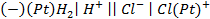
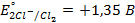
9. Найдите величину электродного потенциала для электрода, составленного из платиновой пластинки, опушенной в раствор смеси солей 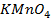
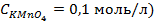
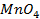
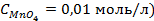
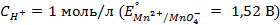
10. Чему равен нормальный электродный потенциал серебра, если потенциал электрода 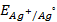
11. Вычислить потенциал свинцового электрода в насыщенном растворе 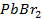
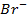
12. ЭДС элемента, состоящего из медного и свинцового электродов, погруженных в 1 М растворы солей этих металлов, равна 0,47 В. Изменится ли ЭДС, если взять 0,001 М растворы? Ответ обосновать.
13. Нормальные потенциалы олова и свинца равны – 0,14 В и -0,13 В. Покажет ли амперметр ток в гальваническом элементе, образованном из полуэлементов
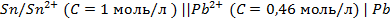
14. Объясните классификацию электродов на электроды 1 и 2 рода. Приведите примеры таких электродов.
15. Зная, что потенциал электрода, отвечающего реакции 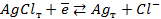
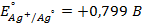
16. Напишите электродные и суммарную реакцию, протекающие в гальваническом элементе, составленном из нормального водородного электрода и цинкового электрода. Укажите, какой заряд будет принадлежать цинковому электроду.
17. В каком направлении пойдет ток в гальваническом элементе, состоящем из водородных электродов, находящихся в растворах с 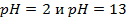
18. Какие процессы происходят на электродах гальванического элемента:
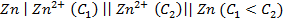
В каком направлении перемещаются электроны во внешней цепи?
19. На основании ряда напряжений металлов составьте гальванический элемент с наибольшей ЭДС и наименьшей его стоимостью. Ответ мотивируйте.
20. Имеются концентрационные цепи:
а) 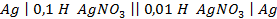
б)
в)
г)
Для каждой из этих цепей:
а) вычислить электродные потенциалы;
б) указать электрод- восстановитель и электрод- окислитель;
в) отметить знаки полюсов и направление перемещения электронов;
г) написать электронно- ионные уравнения восстановления и окисления;
д) вычислить ЭДС.
21. Какие процессы происходят при электролизе расплавов 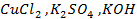
22. Разобрать процессы, протекающие у электродов при электролизе водных растворов:
23. Раствор содержит ионы 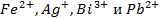
24. Одинаковые ли будут продукты электролиза растворов солей:
а) 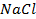
б) 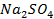
в) 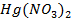
г) 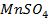
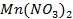
Ответ обосноваться соответствующими электронно- ионными уравнениями.
25. Изменится ли количественное содержание ионов каждой из указанных солей в растворе при электролизе водных растворов:
а) 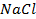
б) 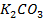
в) 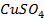
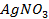
Ответ обосноваться соответствующими электронно- ионными уравнениями.
26. Почему литий нельзя получить электролизом водного раствора его солей? Составьте схему электролиза водного раствора сульфата лития.
27. Электролизом таких соединений и при каких условиях можно получить металлы 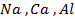
28. Электролиз раствора 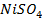
29. Железная и цинковая пластинки погружены в сосуд с раствором серной кислоты так, что они не качаются одна другой. Какие процессы будут протекать на поверхности пластинок, если:
1) пластинки не соединены друг с другом;
2) пластинки соединены;
3) пластинки соединены с полюсами источника тока,
а) цинк будет катодом,
б) цинк будет атодом?
Ответ подтвердить электрохимическими уравнениями.
30. Вычислить количество серебра, выделенного при пропускании через раствор 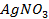
31. Вычислить время, необходимое для полного выделения хлора, содержащегося в 1 л 1 Н раствора 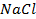
32. Раствор, содержащий 159,54 г соли 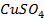
33. Сколько времени требуется для выделения 1 г-экв 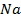
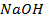
34. Сколько электричества надо пропустить через раствор 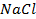
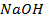
35. Вычислить г-экв 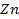
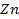
36. Раствор, содержащий 129,7 г соли 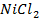
37. При электролизе 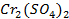
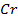
38. Ток одной и той же силы проходит через растворы нитрата серебра 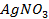
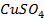
39. В двух отдельных электролизерах проводится электролиз водного раствора 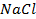
40. При электролизе раствора 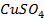
41. Вычислить объём водорода, выделенного при пропускании тока в 5 А в течении 1 ч. через раствор 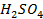
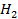
42. Объясните различия между химической и электрохимической коррозией.
43. Почему технический цинк взаимодействует с кислотой более интенсивно, чем химически чистый цинк?
44. В железном изделии имеются детали, изготовленные из меди. Как это отразится на коррозии железа?
45. Объясните, почему цинковое покрытие в стальных трубах, по которым течет горячая вода, интенсивно корродирует?
46. Какое покрытие называется анодным? Приведите пример катодного покрытия железа и составьте электронные уравнения процессов, происходящих при коррозии, когда нарушена целостность покрытия.
47. Какое покрытие называется катодным? Приведите пример катодного покрытия железа и составьте уравнения процессов, происходящих при коррозии, когда нарушена целостность покрытия.
48. Железные цистерны применяются для перевозки концентрированной серной кислоты и хорошо выдерживают транспортировку. Если цистерну, освобождённую от кислоты, оставить открытой, она быстро корродирует. Объясните причину этого явления.
49. Почему при контактированнии железных изделий с алюминиевыми железные изделия подвергаются более интенсивной коррозии, хотя алюминий имеет меньшую величину стандартного потенциала?
50. Составьте уравнение процессов, происходящих при коррозии цинка, погруженного в раствор: а) с кислотой и б) щелочной средой.
51. В чём заключается сущность протекторной защиты металлов от коррозии? Приведите пример и составьте электронные уравнения.
52. Никелевая пластинка опущена в раствор:
а) соли трехвалентного железа,
В каком случае процесс коррозии 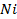
Составьте соответствующие электронные уравнения.
53. Железные пластинки опущены:
а) в дистиллированную воду;
б) в раствор хлористого атрия.
В каком случае процесс коррозии протекает интенсивнее?
54. Под землёй уложены рядом стальные объекты, имеющие различный потенциал (относительно нормального водородного электрода): телефонный кабель в стальной оболочке (+0,05 В), водопровод (-0,15 В), теплоцентраль (0,05 В), газопровод (-0,15 В). Какой из объектов наиболее подвержен коррозии? Что следует сделать для ее замедления?
55. Можно ли поверхность нержавеющей стали обрабатывать песком, содержащим загрязнения в виде хлоридов?
56. Почему отмывка автомобиля от солей и грязи предотвращает его коррозию?
57. Рассчитайте скорость коррозии стального листа размером 1,5х2 м, если убыль его массы составила за 300 дней 6 кг.
58. Объясните связь между защитой окружающей среды и защитой от коррозии.
59. Какие химические реакции происходят при коррозии алюминия в растворе соды?
60. Объясните причину коррозии алюминиевых деталей, обрызганных во время ремонта раствором гидроокиси кальция
61. Чем можно объяснить, что активный металл- алюминий хорошо сопротивляется атмосферной коррозии? Назвать вещество, активирующее коррозию алюминия. Объяснить, в чём заключается активирующее действие.
62. Если хорошо вычищенную наждачной бумагой алюминиевую пластину смочить раствором 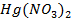
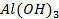
63. Какие способы нанесения металлических покрытий применяются в промышленности?
64. Что такое оксидирование? Привести примеры химического и электрохимического оксидирования алюминия, железа.
65. Какие вещества называются ингибиторами? Какие вы знаете ингибиторы? Механизм действия ингибиторов. Где и когда применяются ингибиторы?
66. Какое из соотношений площадей поверхности катода и анода (например, медного и стального листов) наиболее благоприятно с точки зрения коррозионности: 1:1, 1:10, 10:1?
67. Почему для достижения полной защиты изделия необходимо придерживать определённой минимальной толщины лакокрасочных покрытий?
68. Перечислить требования, предъявляемые к гальваническим покрытиям.
1) -3716 Дж, -4955 Дж; 2) -4955 Дж, -2477 Дж, 2477 Дж, 4955 Дж; 3) -47,78 кДж/моль;
4) -819,67 кДж/моль; 5) 6427 Дж, -12854 Дж; 6) 431,5 кДж/моль; 7) -1579 кДж; 8) 52,2 кДж/моль; 9) -120,4 кДж/моль; 10) -236,8 кДж/моль; 11) 66,08 кДж/моль; 12) -2196,53 кДж/моль; 13) 2453 кДж, 2466 кДж; 14) 2398,1 кДж; 15) 39,4 кДж; 16) -100,5 кДж/моль; 17) 60 кДж; 18) 24,3 кДж/моль; 19) а) 96,8 кДж, б) 490,1 кДж; в) -27,7 кДж; 20) -1113 кДж/моль; 21) а) -443,2 кДж, б) -365,6 кДж; 22) а) -69,2 кДж, б) -2803 кДж; 23) 6С + 3Н2 = С6Н6 (ж); 24) 12,38 кДж; 25) 8,24 кДж; 26) 11395 кДж; 27) 6618,6 кДж; 28) 12254,7 кДж; 29) -798,101 кДж; 30) -897,74; 31)-573,28 кДж; 32) -198,39 кДж; 33) -186,86 кДж; 34) 131,1 кДж, 2926,33 кДж; 35) 23 кДж; 36) 0,083 г; 37) 119,8 кДж; 38) Тепловой эффект уменьшается; 39) 1032,6 Дж/к; 40) 61,1 Дж/кг К; 41) 159,1 Дж/моль к; 42) 154 Дж/моль К;
43) -423,82, 56,71, -5,17 Дж/К; 44) 590,94 кДж/моль. Прямая реакция невозможна; 45)
а) -505,62 кДж/моль, б) -7,51 кДж/моль, в) -4,4 кДж/моль, б и в при стандартных условиях протекает слабо; 48) б) и в); 49) 129,1 кДж, 50,7 кДж, -114,0 кДж, около 1080 К; 50) а) 47,1 кДж, б) 107,2 кДж, в) -13,0 кДж; 51) в) и г) при низкой темпер атуре; 55) 22,03 Дж/моль К; 56) 1601,7 кДж; 57) 36,5 кДж, 4,16 10 -7 ; 58) 2,5 10 -2 ; 59) 885 К; 60) а) 1,1 10 5 , 0,91, б) 1,5
10 -22 , 1,4, в) 2,7 10 5 , 1,1 10 -6 ; 61) б); 63) а); 64) б); 65) а); 70) 985,7 К; 71) 8,02 10 -3 ; 72) 29,2 кДж, 504,7 К; 73) 1,73; 74) 3,8 10 -8 ; 75) 1,6 10 3 , -28478,6 Дж.
1) 5,26 г; 2) 160 г соли и 1440 г воды; 3) 34,78 г; 4) 26,25 г; 5) 1 М; 6) 0,75 г; 7) 1,26 г; 8) 0,5 л; 9) 2,65 г; 10) 3,8 л; 11) 250 мл; 12) 10 г; 13) 0,3 Н, 24 мл; 14) 9,74 г; 15) 244,7 г; 16) 4,762 моль/1000 г Н2О; 19) 2,61 Н, 0,15 г/мл; 20) 5,37 Н, 0,2 г/мл; 21) 0,05 Н; 22) 1,3 Н; 23) 1,62 ° ; 24) 0,26 ° ; 25) 102 ° ; 26) 18,4 г; 27) 1250 г; 28) 4,5 г; 29) 180; 30) 34; 31) 82; 32) 92; 33) -10,1 ° ; 34) 5,2; 35) 178; 36) 500 г; 37) 20 г; 38) -10 ° ; 39) 0,0348 ° ; 40) 0,93 ° ; 41) 0,78; 42) 0,75; 43) 2,5; 44) 102,064 ° ; 45) -0,0279 градусов; 46) 2,96; 47) 3; 48) 1,8 10 -5 ; 49) 10%; 50) 0,018%; 51) 3 10 -7 ; 52) 0,95%; 53) 0,43%; 54) 1,7 10 -3 , 1,7 10 -4 г-ион/л; 55) 9,5 10 -3 ,9,5 10 -4 г-ион/л; 56) 0,072 г-ион/л, 0,144 г-ион/л; 57) 1,9 10 -4 ; 58) 0,6 г-ион/л, 0,3 г-ион/л; 59)0,999 10 -7 г-ион/л; 60)0,5 г-ион/л; 61) 1 10 -4 г-ион/л; 62) 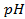
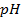
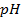
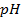
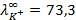
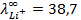
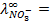
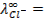
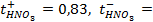
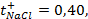
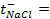
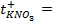
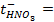
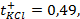
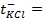
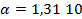
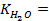
10 -15 ; 117) 0,97; 118) 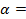
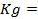
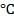
2) -0788 В; 3) -0,18 В, 0,71 В; 4) -0,77 В; 9) 1,53 В; 13) 0; 15) 1,78 10 -10 ; 17) 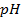
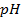
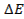
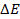
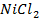
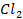
Значение энергии связи
| Тип связи | 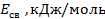 |
| H – H H – C C = C Cl – Cl H – Cl C – C O – O H – O C = O C = C H – O C – O C = O C = O | — 430,0 — 358,2 — 536,0 — 243,0 — 431,5 — 262,8 — 490,4 — 460,0 — 702,9 — 425,0 — 418,4 — 374,0 — 660,0 — 652,7 |
Энергия фазовых переходов
| кДж/моль | |
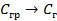 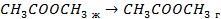 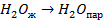 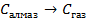 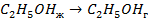 | 33,8 44,0 41,68 |
Стандартные энтальпии образования 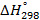
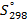
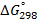
| Вещество | 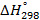 кДж/моль кДж/моль | 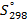 Дж/моль Дж/моль | 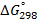 кДж/моль кДж/моль |
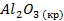 | -1672,0 | ||
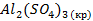 | -3439,0 | ||
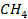 | -74,9 | 186,2 | -50,8 |
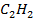 | 226,8 | 200,8 | 209,2 |
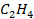 | 52,3 | 219,4 | |
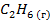 | -84,8 | ||
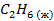 | — | — | 123,48 |
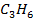 | 20,42 | 267,11 | 61,7 |
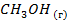 | -201,2 | ||
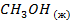 | -238,71 | ||
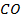 | -110,7 | 197,4 | -137,4 |
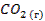 | -394 | 213,6 | -394,89 |
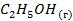 | -235,46 | 278,7 | |
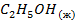 | -277,6 | ||
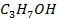 | -171,4 | ||
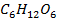 | -1273 | ||
(глюкоза) 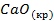 | — | 39,7 | -604,2 |
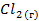 | — | 223,09 | |
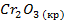 | -1129 | 81,2 | -1050 |
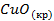 | -162,0 | 42,0 | -129,9 |
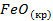 | -2648 | 58,79 | -246 |
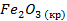 | -822,2 | 87,4 | -740,3 |
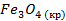 | -1117,1 | 151,46 | -1010 |
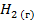 | 130,5 | ||
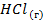 | -92,3 | 186,8 | — |
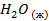 | -285,8 | 70,1 | -237,3 |
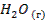 | -241,8 | 188,7 | -228,6 |
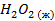 | -187,29 | -218,88 | |
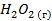 | -135,34 | 227,09 | -203,07 |
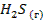 | — | 205,7 | -33,8 |
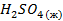 | -194,1 | 157,1 | — |
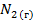 | 191,5 | ||
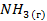 | -46,2 | — | -1655 |
E o , В | |||
| Li + /Li | Li + + e = Li | -3.045 | |
| K + /K | K + + e = K | -2.925 | |
| Ba 2+ /Ba | Ba 2+ + 2e = Ba | -2.906 | |
| Ca 2+ /Ca | Ca 2+ + 2e = Ca | -2.866 | |
| Na + /Na | Na + + e = Na | -2.714 | |
| La 3+ /La | La 3+ + 3e = La | -2.522 | |
| Mg 2+ /Mg | Mg 2+ + 2e = Mg | -2.363 | |
| Be 2+ /Be | Be 2+ + 2e = Be | -1.847 | |
| A1 3+ /A1 | Al 3+ + 3e = Al | -1.662 | |
| Ti 2+ /Ti | Ti 2+ + 2e = Ti | -1.628 | |
| Zr 4+ /Zr | Zr 4+ + 4e = Zr | -1.529 | |
| V 2+ /V | V 2+ + 2e = V | -1.186 | |
| Mn 2+ /Mn | Mn 2+ + 2e = Mn | -1.180 | |
| WO4 2- /W | WO4 2- + 4H2O + 6e = W + 8OH — | -1.05 | |
| Se 2- /Se | Se + 2e = Se 2- | -0.77 | |
| Zn 2+ /Zn | Zn 2+ + 2e = Zn | -0.763 | |
| Cr 3+ /Cr | Cr 3+ + 3e = Cr | -0.744 | |
| Ga 3+ /Ga | Ga 3+ + 3e = Ga | -0.529 | |
| S 2- /S | S + 2e = S 2- | -0.51 | |
| Fe 2+ /Fe | Fe 2+ + 2e = Fe | -0.440 | |
| Cr 3+ ,Cr 2+ /Pt | Cr 3+ + e = Cr 2+ | -0.408 | |
| Cd 2+ /Cd | Cd 2+ + 2e = Cd | -0.403 | |
| Ti 3+ , Ti 2+ /Pt | Ti 3+ + e = Ti 2+ | -0.369 | |
| Tl + /Tl | Tl + + e = Tl | -0.3363 | |
| Co 2+ /Co | Co 2+ + 2e = Co | -0.277 | |
| Ni 2+ /Ni | Ni 2+ + 2e = Ni | -0.250 | |
| Mo 3+ /Mo | Mo 3+ + 3e = Mo | -0.20 | |
| Sn 2+ /Sn | Sn 2+ + 2e = Sn | -0.136 | |
| Pb 2+ /Pb | Pb 2+ + 2e = Pb | -0.126 | |
| Ti 4+ , Ti 3+ /Pt | Ti 4+ +e = Ti 3+ | -0.04 | |
| D + /D2, Pt | D + + e = 1 /2 D2 | -0.0034 | |
| H + /H2, Pt | H + + e = 1 /2 H2 | 0.000 | |
| Ge 2+ /Ge | Ge 2+ + 2e = Ge | +0.01 | |
| Br — /AgBr/Ag | AgBr + e = Ag + Br — | +0.0732 | |
| Sn 4+ , Sn 2+ /Pt | Sn 4+ + 2e = Sn 2+ | +0.15 | |
| Cu 2+ , Cu + /Pt | Cu 2+ + e = Cu + | +0.153 | |
| Cu 2+ /Cu | Cu 2+ + 2e = Cu | +0.337 | |
| Fe(CN)6 4- , Fe(CN)6 3- /Pt | Fe(CN)6 3- + e = Fe(CN)6 4- | +0.36 | |
| OH — /O2, Pt | l /2 O2 + H2O + 2e = 2OH — | +0.401 | |
| Cu + /Cu | Cu + + e = Cu | +0.521 | |
| J — /J2, Pt | J2 + 2e = 2J — | +0.5355 | |
| Te 4+ /Te | Te 4+ + 4e = Te | +0.56 | |
| MnO4 — , MnO4 2- /Pt | MnO4 — + e = MnO4 2- | +0.564 | |
| Rh 2+ /Rh | Rh 2+ /Rh | +0.60 | |
| Fe 3+ , Fe 2+ /Pt | Fe 3+ + e = Fe 2+ | +0.771 | |
| Hg2 2+ /Hg | Hg2 2+ + 2e = 2Hg | +0.788 | |
| Ag + /Ag | Ag + + e = Ag | +0.7991 | |
| Hg 2+ /Hg | Hg 2+ + 2e = Hg | +0.854 | |
| Hg 2+ , Hg + /Pt | Hg 2+ + e = Hg + | +0.91 | |
| Pd 2+ /Pd | Pd 2+ + 2e = Pd | +0.987 | |
| Br — /Br2, Pt | Br2 + 2e = 2Br — | +1.0652 | |
| Pt 2+ /Pt | Pt 2+ + 2e = Pt | +1.2 | |
| Mn 2+ , H + /MnO2, Pt | MnO2 + 4H + + 2e = Mn 2+ + 2H2O | +1.23 | |
| Cr 3+ , Cr2O7 2- , H + /Pt | Cr2O7 2- + 14H + + 6e = 2Cr 3+ + 7H2O | +1.33 | |
| Tl 3+ , Tl + /Pt | Tl 3+ + 2e = Tl + | +1.25 | |
| Cl — /Cl2, Pt | Cl2 + 2e = 2Cl — | +1.3595 | |
| Pb 2+ , H + /PbO2, Pt | PbO2 + 4H + + 2e = Pb 2+ + 2H2O | +1.455 | |
| Au 3+ /Au | Au 3+ + 3e = Au | +1.498 | |
| MnO4 — , H + /MnO2, Pt | MnO4 — + 4H + + 3e = MnO2 + 2H2O | +1.695 | |
| Ce 4+ , Ce 3+ /Pt | Ce 4+ + e = Ce 3+ | +1.61 | |
| SO4 2- ,H + /PbSO4, PbO2, Pb | PbO2 + SO4 2- + 4H + + 2e = PbSO4 + 2H2O | +1.682 | |
| Au + /Au | Au + + e = Au | +1.691 | |
| H — /H2, Pt | H2 + 2e = 2H — | +2.2 | |
| F — /F2, Pt | F2 + 2e = 2F — | +2.87 |
Пример 12-1. Рассчитать стандартный электродный потенциал пары Cu 2+ /Cu + по данным таблицы 11.1 для пар Cu 2+ /Cu и Cu + /Cu.
Cu 2+ + 2e = Cu 
Cu + + e = Cu 
Cu 2+ + e = Cu + 
откуда E o = +0.153 В.
Пример 12-2. Составить схему гальванического элемента, в котором протекает реакция
Рассчитать стандартную ЭДС элемента при 25 o C, 
Ag | AgBr| Br — || Ag + | Ag
Правый электрод: Ag + + e = Ag E o = 0.7792 В
Левый электрод: AgBr + e = Ag + Br — E o = 0.0732 В
Общая реакция: Ag + + Br — = AgBr E o = 0.7260 В


1/K= a(Ag + ) . a(Br — ) = m(Ag + ) . m(Br — ) . ( 

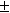
Отсюда, полагая 
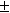
Пример 12-3. 







Ответ. 
12-1. Рассчитать стандартный электродный потенциал пары Fe 3+ /Fe по данным таблицы 12.1 для пар Fe 2+ /Fe и Fe 3+ /Fe 2+ . (ответ)
12-2. Рассчитать произведение растворимости и растворимость AgCl в воде при 25 o C по данным таблицы 12.1. (ответ)
12-3. Рассчитать произведение растворимости и растворимость Hg2Cl2 в воде при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-4. Рассчитать константу равновесия реакции диспропорционирования 2Cu + 
12-5. Рассчитать константу равновесия реакции ZnSO4 + Cd = CdSO4 + Zn при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-6. ЭДС элемента, в котором обратимо протекает реакция 0.5 Hg2Cl2 + Ag = AgCl + Hg, равна 0.456 В при 298 К и 0.439 В при 293 К. Рассчитать 


12-7. Вычислить тепловой эффект реакции Zn + 2AgCl = ZnCl2 + 2Ag, протекающей в гальваническом элементе при 273 К, если ЭДС элемента E= 1.015 В и температурный коэффициент ЭДС = — 4.02 . 10 -4 В . K -1 . (ответ)
12-8. В гальваническом элементе при температуре 298 К обратимо протекает реакция Cd + 2AgCl = CdCl2 + 2Ag. Рассчитать изменение энтропии реакции, если стандартная ЭДС элемента E o = 0.6753 В, а стандартные энтальпии образования CdCl2 и AgCl равны -389.7 и -126.9 кДж . моль -1 соответственно. (ответ)
12-9. ЭДС элемента Pt | H2 | HCl | AgCl | Ag при 25 o C равна 0.322 В. Чему равен pH раствора HCl . (ответ)
12-10. Растворимость Cu3(PO4)2 в воде при 25 o C равна 1.6 . 10 -8 моль . кг -1 . Рассчитать ЭДС элемента Pt | H2 | HCl (pH = 0) | Cu3(PO4)2 (насыщ. р-р) | Cu при 25 o C. (ответ)
12-11. Три гальванических элемента имеют стандартную ЭДС соответственно 0.01, 0.1 и 1.0 В при 25 o C. Рассчитать константы равновесия реакций, протекающих в этих элементах, если количество электронов для каждой реакции n = 1. (ответ)
12-12. ЭДС элемента Pt | H2 | HBr | AgBr | Ag в широком интервале температур описывается уравнением: E o (В) = 0.07131 — 4.99 . 10 -4 (T — 298) — 3.45 . 10 -6 (T — 298) 2 . Рассчитать 


12-13. Для измерения pH раствора можно применять хингидронный электрод. (Хингидрон, Q . QH2, представляет собой комплекс хинона, Q = C6H4O2, и гидрохинона, QH2 = C6H4O2H2). Электродная полуреакция записывается как Q + 2H + + 2e 
12-14. В гальваническом элементе обратимо протекает реакция CuSO4 + Zn = ZnSO4 + Cu. Рассчитать 

12-15. В элементе Вестона протекает реакция Cd + Hg2SO4 = Cd 2+ + 2Hg. Рассчитать ЭДС этого элемента при 303 K, если 

12-16. 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
http://helpiks.org/9-27166.html
http://www.chem.msu.ru/rus/teaching/eremin/12.html









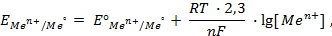
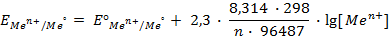
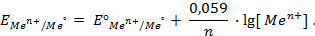
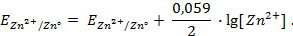
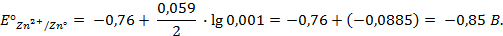
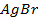
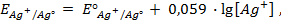
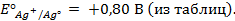
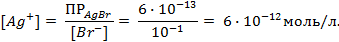
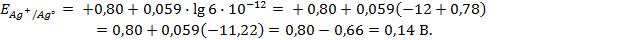
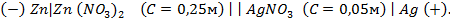
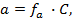
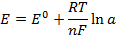
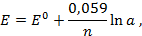
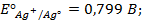
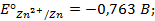
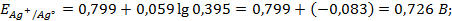
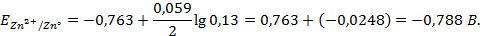
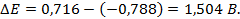
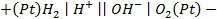
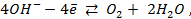
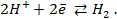
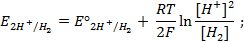
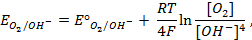
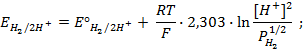
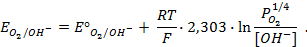
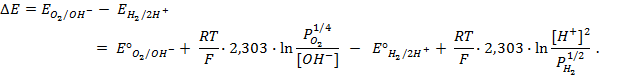
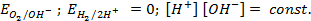
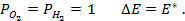
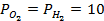
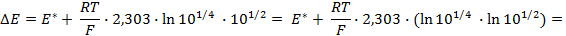
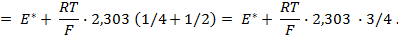
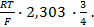
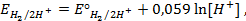
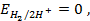
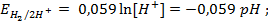
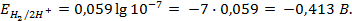
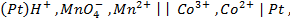
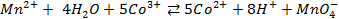
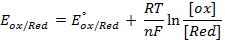
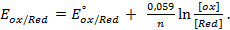
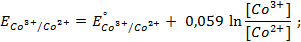
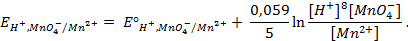
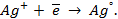
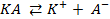


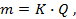
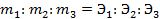
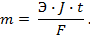
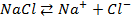
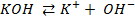
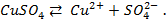
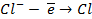
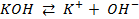
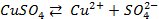
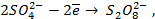
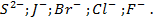
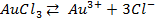
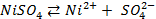
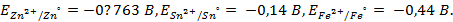
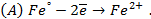
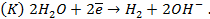
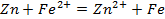
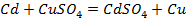
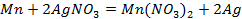
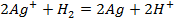
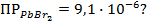
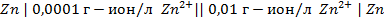
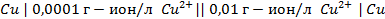
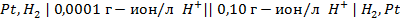
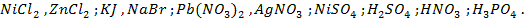
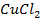
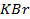
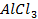
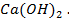
 ,
,
 .
. .
. = 1.54 . 10 37 .
= 1.54 . 10 37 .