Золото (Au)
Золото является одним из самых «необычных» металлов, известных человеку с давних пор — наши предки использовали золото по большей части в культурно-религиозных целях, а также в качестве одного из самых надежных платежных средств.
Золото в природе встречается в подавляющем большинстве случаев в виде самородков. С некоторыми металлами золото может образовывать природные твердые растворы:
- электрум — серебристое золото;
- аурокуприд — меднистое золото;
- платинистое золото.
В виде соединений золото в природе встречается гораздо реже (калагерит AuTe2, ауростибит AuSb2). Достаточно много золота содержится в морской воде, но добыча такого золота нерентабельна.
Рис. Строение атома золота.
Электронная конфигурация атома золота — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 1 (см. Электронная структура атомов). Золото является одним из самых малоактивных химических элементов — оно не окисляется на воздухе даже в присутствии влаги, не взаимодействует непосредственно с кислородом, водородом, азотом, углеродом, фосфором.
Физические свойства золота:
- золотисто-желтый металл;
- очень пластичный и мягкий — можно раскатать в прозрачную фольгу толщиной несколько микрон (сусальное золото), которой покрывать разнообразные художественные и религиозные изделия (производить золочение), придавая им эстетический привлекательный вид, который сохраняется длительное время;
- обладает хорошей электро- и теплопроводностью.
Химические свойства золота:
- реагирует с галогенами при нагревании: 2Au + 3Cl2 = 2AuCl3;
- не растворяется в щелочных и кислотных растворах;
- растворяется в смесях кислот: HCl+HNO3 (царской водке) и H2SO4+HNO3: Au + 3HNO3 + 3HCl = AuCl3 + 3NO2 + 3H2O;
- металлическое золото переходит в раствор в виде комплексной соли в водных растворах цианида калия и натрия в присутствии окислителей: 4Au + 8KCN + 2H2O + O2 = 4K[Au(CN)2] + 4KOH;
- легко растворяется в ртути с образованием сплава (амальгамы).
Кислородные соединения золота при незначительном нагревании легко разлагаются со взрывом, например, гремучее золото взрывается при 145°C.
Соединения золота достаточно легко гидролизуются и восстанавливаются до свободного металла в водных растворах, поскольку являются неустойчивыми соединениями: при нагревании гидроксид золота (III) дегидратируется образуя оксид золота (III), который, в свою очередь, распадается с образованием свободного золота при 160°C: 4Au(OH)3 → 2Au2O3 → 4Au + 3O2.
Гидроксид и оксид золота (III) — амфотерные соединения, реагируют с кислотами и основаниями, образуя комплексные соединения:
Применение золота:
- в ювелирном деле;
- как международное платежное средство;
- в электротехнике для золочения контактов;
- для нанесения покрытий на металлические поверхности;
- в медицине для изготовления инструментов и протезов;
- как катализатор при проведении некоторых реакций в химической промышленности;
- радиоактивный изотоп золота применяют в онкологии для лечения новообразований.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Оксид золота III
| Оксид золота III | |
|---|---|
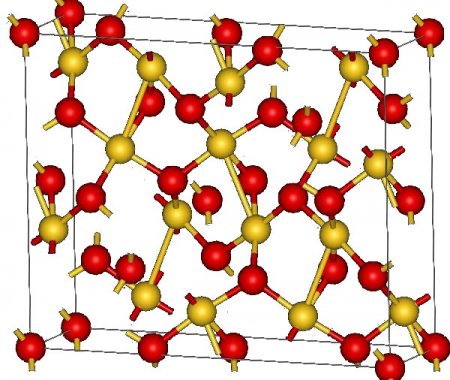 | |
| Систематическое наименование | Оксид золота III |
| Традиционные названия | Окись золота |
| Хим. формула | Au2O3 |
| Состояние | красно-бурый порошок |
| Молярная масса | 441,93 г/моль |
| Плотность | 10,38 г/см³ |
| Растворимость | |
| • в воде | не раств. |
| Рег. номер CAS | 1303-58-8 |
| PubChem | 164805 |
| Рег. номер EINECS | 215-122-1 |
| SMILES | |
| Номер ООН | |
| ChemSpider | 144478 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид золота III — бинарное неорганическое химическое соединение золота и кислорода с формулой Au2O3. Наиболее устойчивый оксид золота.
Получение
Получается из гидроксида золота III Au2O3 x H2O обезвоживанием при нагревании. Полная потеря воды наступает при температуре около 200 о C. Полученный таким образом оксид золота(III) аморфен. Имеет красный или красно-бурый цвет. Примесь бурого, как и в случае гидроксида золота III, обычно связывают с присутствием небольшого количества золота(0). Монокристаллы Au2O3 были получены из аморфного оксида гидротермальным синтезом в кварцевой ампуле, заполненной на треть смесью хлорной кислоты HClO4 и перхлората щелочного металла (температура синтеза 235—275 о С, давление до 30 МПа). Полученные монокристаллы имели рубиново-красный цвет.
Свойства
Структура кристаллического Au2O3 орторомбическая, группа Fdd2. Атомы золота имеют тетрагональную (близкую к квадратной) координацию атомами кислорода со средним расстоянием Au-O 2,02—2,03 А. Часть атомов кислорода являются мостиковыми — одни связаны с двумя атомами золота, другие с тремя.
По данным кристаллографии, плотность равна 10,38 г / см 3 .
Нагрев аморфного оксида золота III до 260—300 о С приводит к полному разложению с выделением кислорода и металлического золота, хотя разложение начинается уже при более низкой температуре.
Оксид золота III нерастворим в воде. Заметно, хотя и медленно, растворяется в растворах щелочей, образуя тетрагидроксокомплекс Au(OH)4 — . Встречающиеся указания на амфотерность требуют уточнения. Поскольку золото III никогда не образует в растворе простых солей с катионом Au 3+ , а получаются только комплексные формы, то растворимость Au2O3 в некоторых кислотах обусловлена не только взаимодействием с H + , но в первую очередь именно комплексообразованием с анионом кислоты. Так, оксид золота III хорошо растворяется в соляной кислоте, давая HAuCl4. Умеренно растворим в азотной и серной кислотах, давая смешанные аквагидроксонитратные или аквагидроксосульфатные комплексы типа Au(OH)i(H2O)jXk z (где i + j + k = 4, X = NO3 или SO4, z = -i + kzX). Нерастворим в хлорной кислоте любой концентрации.
Оксид золота в виде плёнки на инертной подложке испытывался для получения токопроводящих соединений («золотых дорожек») в микроэлектронике. Плёнки получали магнетронным напылением, разложение оксида до золота в нужных местах проводили при помощи лазера
Свойства и особенности оксидов золота
Читайте в этой статье:
Оксид золота — это химическое соединение, в котором задействованы кислород и золото. Как известно, Au относят к благородным металлам, элемент характеризуется таким образом потому, что он не вступает в контакт с реагентами. Кислород, вода, кислоты и щелочи никаким образом не способны навредить золоту и еще шести металлам платиновой группы. Так как же получить химическое соединение кислорода с золотом, если металл инертен?
Оксиды и их свойства
Оксид золота в природе не образуется, элементы, с которыми соединяется этот металл, можно пересчитать по пальцам. Их крайне мало. Если говорить о чистом золоте, то кислород его не разрушает, то же самое можно сказать о воде и большом количестве других реагентов.

Золото окисляется только при взаимодействии со следующими элементами:
- ртутью;
- смесью соляной и азотной кислот;
- селеновой кислотой;
- хлором и бромом.
Если говорить о ртути, то при взаимодействии элементов образуется сплав, который химики называют амальгамой.
Смесь азотной и соляной кислот в пропорции 1 к 3 называют царской водкой, при погружении в эту смесь металл начинает растворяться. При повышении температуры реакция ускоряется.
Селеновая кислота в высокой концентрации способна окислить золота, подобная технология применяется только в промышленности, для извлечения благородного элемента из породы.
Хлор и бром могут взаимодействовать с Au, присутствие хлора в реакции ускоряет процесс. По этой причине не рекомендуется надевать золотые украшения во время уборки, им может быть нанесен вред.
Оксид золота имеет несколько разновидностей, также существует и гидроксид, который является смесью золота, кислорода и водорода. Если говорить проще, это смесь воды и благородного металла. Но поскольку металл инертен, получить такую смесь не так просто.
Чистое золото окисляться может только при определенных обстоятельствах. Для этого необходимо поддержание температурного режима и соблюдение условий.
Оксид золота бывает всего двух разновидностей, определить, о каком именно химическом элементе идет речь, можно при помощи обозначения. Химики дополняют название веществ римскими цифрами I и III.
Элемент представляет собой неорганическое соединение, окись металла и кислорода, рассматривается как соль аурат или окисел смешанного типа. Представляет собой порошок коричневого цвета.
Окись золота можно получить несколькими способами, но в реакции обязательно должен участвовать кислород.
Соединение воды и Au под номером I получают путем нагревания элемента с аналогичным названием, но под номером III. А для получения оксида понадобится гидроксид, то есть соединение металла с водой.

- имеет химическую формулу Au2O3;
- отличается устойчивостью;
- получают путем обезвоживания при нагревании;
- элемент аморфен;
- имеет красный или бурый оттенок.
Реакция проходит в ампуле из кварца, которая на одну треть должна быть заполнена хлорной кислотой, при температуре в 200 градусов. Из соединения путем повышения температуры испаряют воду, в результате получают порошок красного или бурого оттенка. Бурый оттенок свидетельствует или о низком качестве металла, или его небольшом содержании.
При повышении температуры можно получить кристаллы, которые будут иметь рубиновый оттенок. Показатели должны быть примерно 240–270 градусов.
Можно характеризовать соединение под номером III следующими свойствами:
- Не растворяется в воде.
- Плотность элемента составляет 10,38 г на куб. см.
- Если нагреть элемент до 300 градусов, то пойдет реакция с полным разложением.
- Растворяется в щелочах, но реакция идет медленно.
Кристаллы соединяются друг с другом по типу мостика, то есть одна молекула цепляет две, две молекулы цепляют три и таким образом — по восходящей.
Можно заметить, что оксид имеет определенное сходство с металлом, например, элемент так же ускоренно растворяется в соляной и азотной кислотах.
Что может элемент под номером I и какими обладает свойствами:
- имеет химическую формулу Au2O (две молекулы золота присоединяют одну молекулу кислорода);
- выглядит как порошок синего цвета;
- соединение неустойчивое;
- может находиться в виде гидрозоля.
Получают элемент при нагревании, для проведения реакции понадобятся гидроксид калия и хлорид золота.
Соединение быстро возвращается в первоначальное состояние, по этой причине элемент рассматривают как порошок, который может иметь фиолетовый оттенок. При повышении температуры соединение разлагается.
Если добавить в соединение гидроксид аммония, или, говоря проще, нашатырь, то в процессе реакции образуется осадок черного цвета. При силовом воздействии (от удара) соединение может взорваться.
Соединение с химической формулой 3Au2O·4NH3, не отличается устойчивостью, распадается в горячей воде, не образует осадка.
Почему происходит окисление?
Окисление может происходить по нескольким причинам; если говорить об обычных металлах, то они взаимодействуют с кислородом и водой, также на элементы могут воздействовать реагенты: щелочи и кислоты. Если реакция проходит в лабораторных условиях, то реагенты используют с определенной целью. В домашних условиях столкнуться со щелочами и кислотами можно при выполнении работ по дому, поскольку большое количество средств для уборки состоит из химических соединений, в состав которых входят либо щелочи, либо кислоты.
Если говорить о чистом золоте и металлах платиновой группы, то они к окислению несвойственны, подобная реакция возможна только в условиях лабораторий с использованием определенных реагентов, которых не так много.
Золото в украшениях может окисляться по причине того, что в состав изделий входят и другие материалы. Сплав готовят из нескольких элементов, разбавляя благородный металл латунью, никелем или медью. Эти элементы не столь устойчивы к факторам внешней среды и реагентам, из-за чего на поверхности драгоценностей и образуется налет. По этой причине стоит беречь украшения и правильно ухаживать за ними. Чем больше в сплаве лигатуры и других примесей помимо золота, тем сильнее оно подвержено коррозии.
Учитывая все свойства золота и характеристики, получение оксида этого металла — это трудоемкий процесс, провести который можно только в лабораторных условиях. Провести процедуру дома, без наличия оснащения невозможно.
Не так давно ученым удалось исполнить мечту всех алхимиков и получить Au из ртути, соединение получилось устойчивым. Но искусственный металл и его производство было признано неперспективным.
Возможно, в скором времени, химики удивят еще чем-нибудь и научатся добывать или синтезировать благородный металл в промышленном масштабе.
http://chem.ru/oksid-zolota-iii.html
http://hochuzoloto.com/prochee/oksid-zolota.html